公告中介绍,Ad5-nCoV的I期及II期临床试验已在中国开展,并于6月11日完成II期临床试验揭盲。临床试验数据证实其具有良好的安全性,及较高的体液免疫及细胞免疫应答水平。
康希诺生物表示,总体试验结果表明,Ad5-nCoV具有预防由SARS-CoV-2(严重呼吸综合征2型冠状病毒)引起的疾病的潜力。根据《中国人民解放军实施〈中华人民共和国药品管理法〉办法》有关规定,Ad5-nCoV现阶段仅限军队内部使用,未经军委后保部批准,不得扩大接种范围。
公告同时提醒投资者:康希诺生物无法保证能最终成功商业化Ad5-nCoV。
今天港股开盘,康希诺生物-B高开4.2%,盘中最高涨幅达8%,截至发稿,涨幅回落至3.2%,市值505亿港元。今年以来,其股价涨幅高达284%。
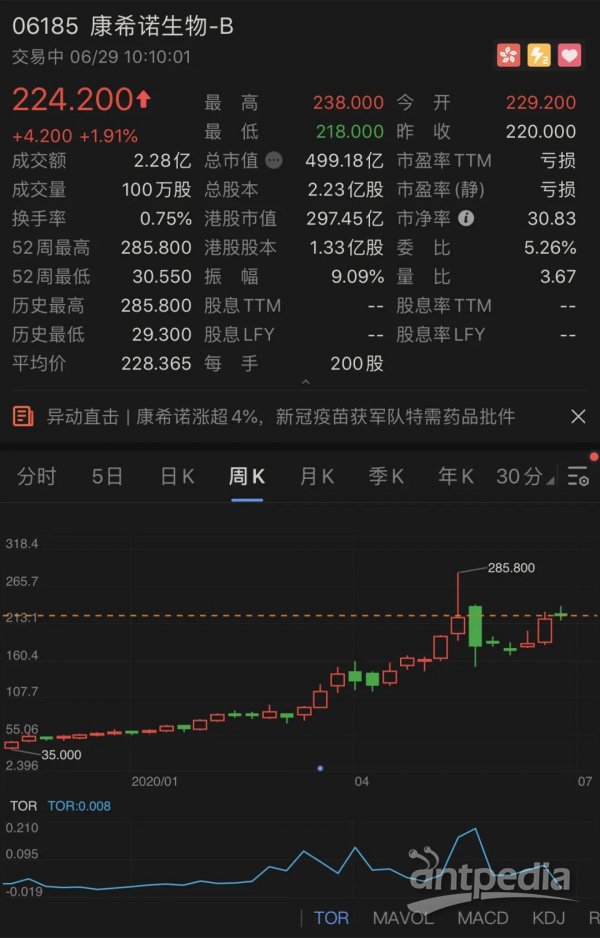
康希诺生物股价走势(周K)
2009年,康希诺生物注册于天津滨海新区,去年3月赴港上市,从事人用疫苗的研发、生产和商业化。今年1月,其正式递交科创板上市申请并获受理,拟募集资金用于新型疫苗产能扩大与产品研发。
Ad5-nCoV疫苗由康希诺生物和军事科学院陈薇院士团队联合开发。
该疫苗是一种表达SARS-CoV-2刺突糖蛋白(S蛋白)的复制缺陷Ad5载体疫苗。疫苗使用一种减毒的普通感冒病毒(腺病毒,易感染人类细胞,但不致病)将编码SARS-CoV-2刺突(S)蛋白的遗传物质传递给细胞。随后这些细胞会产生S蛋白,并到达淋巴结,免疫系统产生抗体,识别S蛋白并击退冠状病毒。
5月22日,国际学术期刊《柳叶刀》在线发表全球首个重组腺病毒5型载体新冠疫苗I期临床试验结果。其主编理查德·霍顿评价道:“首次对此新冠病毒疫苗的人体实验结果发现,它具有良好的安全性和耐受性,并且能够诱导快速的免疫反应。这些结果代表着一个重要的里程碑。”
对于实验结果,陈薇院士指出:“这些结果使其成为具有潜力的可以进行下一步研究的候选疫苗。”
不过,她同时强调,“我们对这些结果应谨慎解读。研发COVID-19疫苗的挑战是前所未有的,诱导免疫应答的能力并不一定表明该疫苗能完全保护人类免受SARS-CoV-2的感染。这些结果为新冠疫苗研发提供了积极前景,但距离该疫苗上市,我们还有很多工作要做。”

陈薇院士查看核酸检测数据 图片来源:中国军网
事实上,疫情发生之初,我国科研攻关团队就把疫苗研发作为主攻方向之一,按照灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗和核酸疫苗等5条技术路线,共布局12项研发任务。目前已对1个腺病毒载体疫苗和4个灭活疫苗开展临床试验,占全世界开展临床试验疫苗总数的4成。
6月19日,联防联控机制疫苗研发专班专家组副组长王军志介绍,目前我们国家新冠疫苗的研究,已经有五家进入了临床试验阶段,其中,有三家已经完成了II期临床,所有研究的过程、研发的过程、评价的标准、保证安全有效的技术指南,都是符合国际标准的。
“下一步就必须积极开展临床III期试验,获得真正疫苗大人群的有效性保护率数据,这个对我们的疫苗最终取得成功极为重要。”他表示。
6月23日晚间,国药集团中国生物宣布,全球首个新冠灭活疫苗国际临床(三期)试验在阿联酋启动。这也是中国新冠疫苗在海外开展的第一个临床试验。
疫苗Ⅲ期临床试验为何要去国外做?
武汉生物制品研究所所长段凯介绍,临床研究通常分为三期。Ⅰ期主要评价安全性。Ⅱ期主要评价疫苗安全性和免疫原性,同时探索免疫程序。Ⅲ期主要在更大人群范围内评价疫苗的安全性和有效性。
“鉴于国内疫情得到有效控制,不具备Ⅲ期临床试验条件,新冠疫苗如果要做临床研究,要到国外疫情比较高发的地方去做。安全性评价贯穿整个临床研究全过程。如果Ⅲ期临床试验成功,说明这些疫苗是安全的、有效的,能保护接种人群免于新冠病毒感染。”他表示。