治疗选择·细胞层面理解
从2019年底由SARS-CoV-2(2型严重急性呼吸综合征冠状病毒)引起的新型冠状病毒疾病(COVID-19)具有高传染性,该病已发展至全球大流行。全球迫切需要开发抑制病毒感染或复制的疗法。SARS-CoV-2与其他冠状病毒有相似之处,所以目前主要通过对已用于其他适应症的药物库进行高通量筛选,鉴定出许多临床上认可的药物,但却缺乏对SARS-CoV-2感染的治疗选择和细胞层面理解。
法兰克福大学医学病毒学研究所的Jindrich Cinatl教授和歌德大学医学院的Christian Münch教授团队发表最新研究中,建立感染SARS-CoV-2的Caco-212细胞模型,运用一种新颖的多重增强蛋白质动力学(multiplexed enhanced protein dynamicsme, mePROD)方法进行蛋白质组学分析,能够在高时间分辨率下确定转录组和蛋白质组的变化,加速确证病毒致病性相关的生物途径以及寻找潜在的药物靶标。
一、构建细胞感染模型
想要开展该研究的重点取决于两点:1.是否有合适的允许病毒感染的细胞培养模型;2.对蛋白质进行时间感染特征分析的敏感蛋白质组学方法。
该研究建立针对SARS-CoV-2高度兼容的细胞模型,在病毒感染24小时后就能迅速见到细胞致病作用 (图1A)。在病毒感染细胞后的2h、6h、10h和24h,分别用定量PCR技术测量上清液中的病毒RNA拷贝数,发现感染后SARS-CoV-2 RNA数量不断增加(图1B)。这表明模型可以用于研究细胞中SARS-CoV-2。
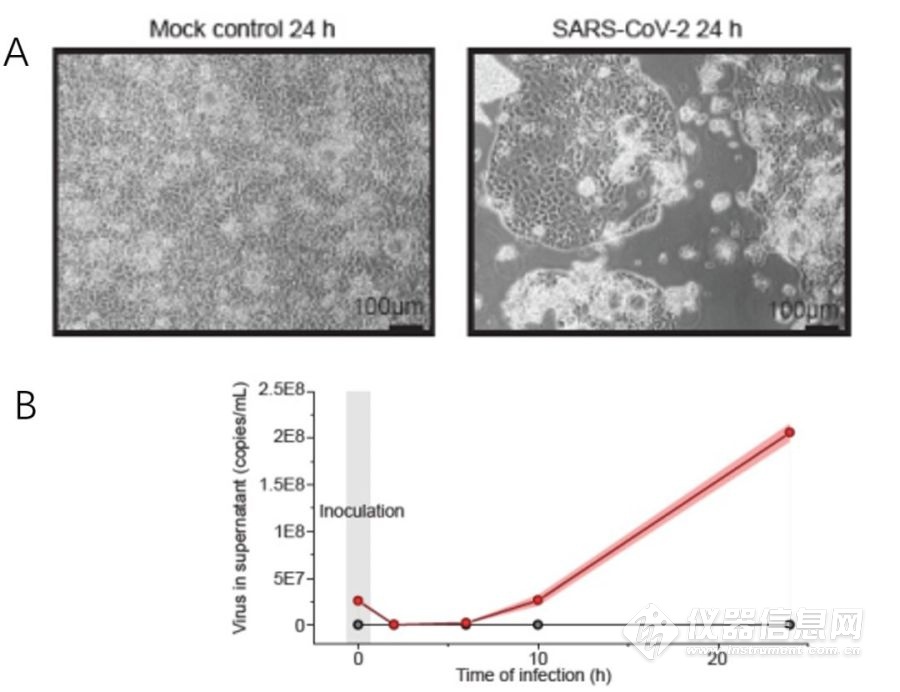
图1. SARS-CoV-2 在细胞内快速复制模型。A, 病毒感染24小时后的细胞形态变化; B, 细胞上清液中病毒RNA拷贝数的增加
二、翻译抑制剂防止SARS-CoV-2病毒复制
建立好模型,研究人员需要利用一种高效的方法确定SARS-CoV-2感染的时间分布,这时候mePROD蛋白质组学方法应运而生,即基于Orbitrap高分辨质谱仪联用新蛋白代谢标记(SILAC)和串联质量标签(TMT)两种标记方法,进行蛋白差异分析。
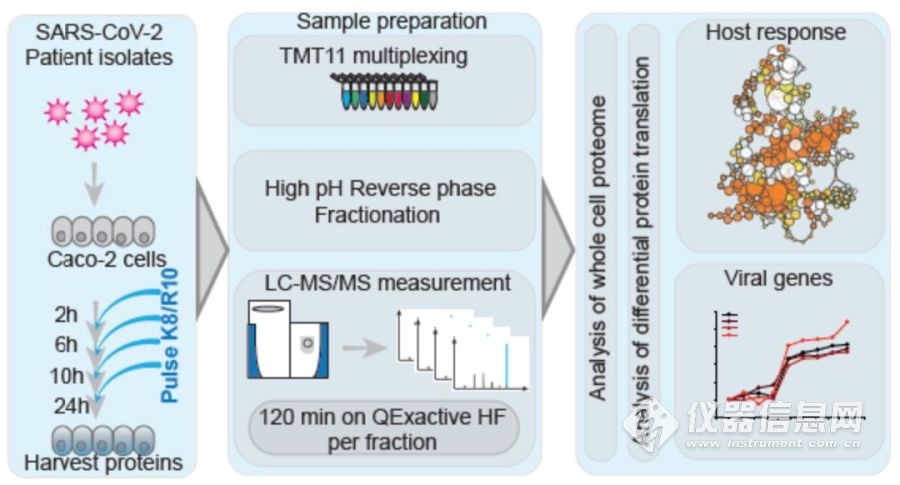
图2. mePROD蛋白质组学实验流程
抑制宿主翻译先前已被用作治疗MERS-CoV等多种冠状病毒感染性疾病。与其他病毒抑制宿主蛋白的合成从而增加病毒蛋白的合成不同,该方法挖掘数据表明SARS-CoV–2仅引起宿主翻译能力的微小变化,作者推测SARS-CoV-2复制可能对翻译抑制更为敏感。通过测试了两种翻译抑制剂,即环己酰亚胺(cycloheximide, 翻译延伸抑制剂)和曲美汀(emetine, 抑制40S核糖体蛋白S14)。在无毒浓度下,两个化合物均对SARS-CoV-2复制产生了显着抑制作用从而发现翻译抑制剂是细胞中SARS-CoV-2复制的有效抑制剂。
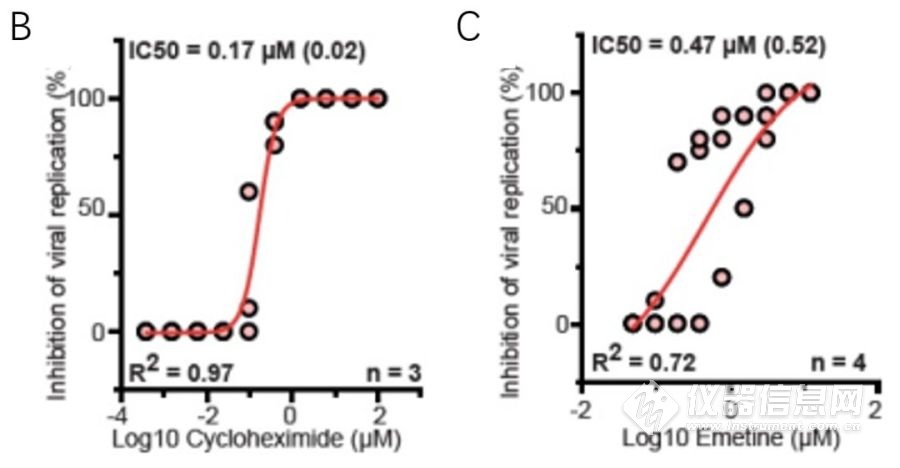
图3. 环己酰亚胺和曲美汀对病毒复制的抑制作用
三、发现潜在的抗病毒靶标
重点来了,通过前期蛋白质组学大数据挖掘,目前一张蓝图已展现在眼前,下一步的重中之重就是探究与病毒蛋白共同增加的宿主蛋白,从而寻求潜在的SARS-CoV-2复制抑制剂。
作者分析了与病毒蛋白变化趋势相似的蛋白,在数据中富集的代谢途径主要由不同的核酸代谢子途径组成。基于此,研究者测试核苷酸合成抑制剂对细胞中SARS-CoV-2复制的影响,高达10 µM的布雷奎纳(brequinar,抑制双氢乳清酸脱氢酶并不具有抗病毒的作用。相比之下,低浓度下的利巴韦林(ribavirine,抑制肌苷一磷酸脱氢酶)即可抑制SARS-CoV-2复制(图4C),这表明利巴韦林是可以进行进一步检测的候选药物。
此外,与蛋白质折叠相关的蛋白变化与病毒蛋白质较为一致,p97是AAA家族的六聚体ATPase酶,也是真核生物最丰富的蛋白之一,通过调节蛋白的稳定性来执行一系列生物学功能,参与膜融合、蛋白降解等过程。测试p97的小分子抑制剂NMS–873对SARS-CoV-2复制的影响。研究表明,NMS–873在低纳摩尔浓度下即可完全抑制SARS-CoV–2(图4D)。
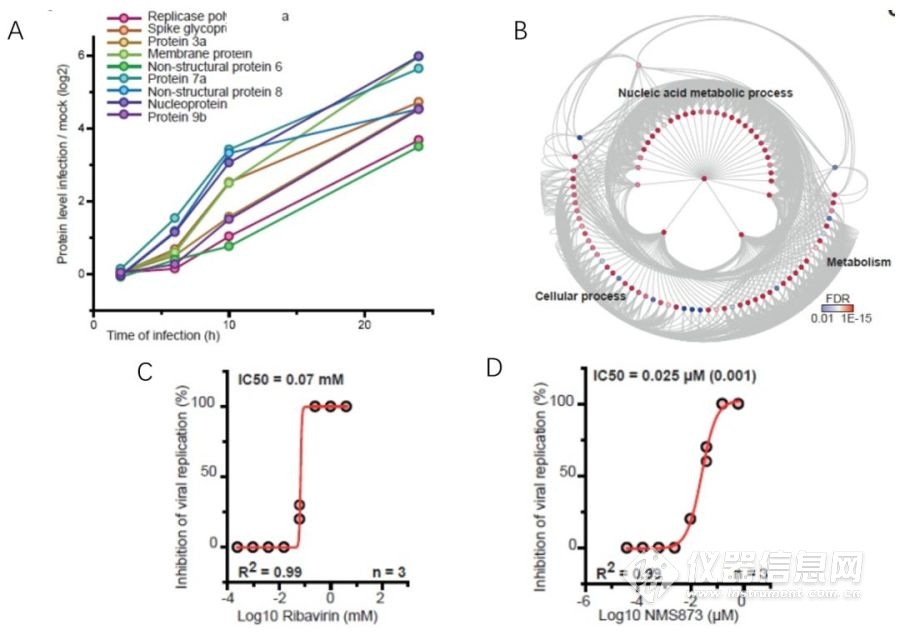
图4. 核酸代谢相关的蛋白水平与病毒基因表达相关。A, 病毒蛋白随感染时间的变化;B, 宿主蛋白与病毒蛋白关联的GO分析;C, D, Ribavirin和NMS–873的抗病毒实验
结论
全球对于病毒高效治疗方案的需求非常紧迫,深入了解病毒机理及致病性相关的生物途径变得非常关键。定量蛋白质组学是病毒机理研究的主要手段之一,能够提供超高分辨率和灵敏度,可为病毒蛋白质组学研究者所面临的挑战“样本基质复杂、蛋白质鉴定数量不足、假阴性/假阳性结果”提供强大的技术保障。
参考文献:
SARS-CoV-2 infected host cell proteomics reveal potential therapy targets, DOI:10.21203/rs.3.rs-17218/v1