在国家自然科学基金委、科技部和中国科学院的支持下,中科院化学研究所分子识别与功能重点实验室研究员程靓团队长期从事该领域的基础研究,发展了一系列针对重要RNA表观遗传修饰的高选择、高灵敏、时空分辨的化学转化、荧光标记的原理和方法。他们前期报道了首例在蓝光照射下,维生素B2选择性促进核苷水平的m6A去甲基化研究(Chem.Commun.2017,53,10734),为后续在细胞水平调控m6A奠定了基础。
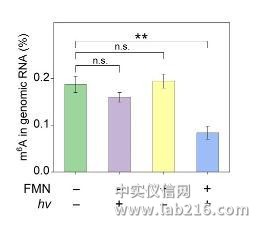
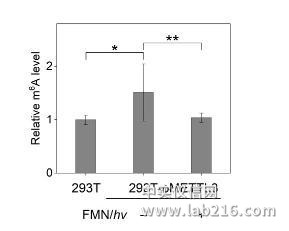
最近,他们和活体分析化学重点实验室研究员汪铭课题组合作,首次实现了化学小分子对RNA表观遗传修饰的直接干预。研究表明,核黄素单核苷酸(FMN)作为人工去甲基化酶,能够利用细胞中的氧气实现核苷、寡核苷酸以及活体细胞水平上的m6A去甲基化。FMN的作用方式是特异性地氧化N6-甲基取代的腺苷,而不是传统的作为甲基化酶的抑制剂或去甲基化酶的激动剂。即使在甲基化酶过表达的细胞中,FMN依然可以有效地下调m6A的表达水平,表明FMN有望作为新型的靶向m6A修饰的小分子抑制剂进行开发,对治疗由m6A过表达引起的生理疾病以及深入研究m6A的生物学功能提供了候选化合物。相关成果发表于《德国应用化学》(Angew.Chem.Int.Ed.DOI:10.1002/anie.201900901)。
北京基因组所等揭示RNAm6A修饰调控抗肿瘤免疫机制
免疫治疗是对抗肿瘤的前沿阵地,其治疗成功的关键是引发针对肿瘤抗原的自发性T细胞反应。许多病人的免疫系统无法有效识别肿瘤抗原,难以引发持续性的T细胞应答并清除肿瘤。研究免疫系统识别肿瘤抗原的分子机制有望发现新型药物靶点,提高免疫治疗效果。
中国科学院北京基因组研究所韩大力团队与清华大学徐萌团队、美国芝加哥大学何川团队合作发现,RNAm6A修饰通过调控树突状细胞的溶酶体组织蛋白酶翻译效率,影响肿瘤抗原特异性的T细胞免疫应答新机制,相关研究成果2月7日在线发表于《自然》杂志。
m6A修饰是mRNA上丰度最高的修饰类型,负责对mRNA分子进行转录后调控。m6A修饰通过其结合蛋白YTHDF1影响下游基因的翻译效率。韩大力及其合作者发现,RNAm6A修饰通过YTHDF1调控肿瘤抗原特异性免疫反应。相比于野生型小鼠,YTHDF1敲除小鼠展现出较强的肿瘤抗原特异性CD8+T细胞应答。进一步研究表明,体内删除树突细胞中的YTHDF1会提升其对肿瘤抗原的交叉呈递能力和T细胞的交叉激活。结合m6A-Seq、Ribo-Seq等转录组学数据发现,多个树突细胞溶酶体组织蛋白酶的转录本均带有m6A修饰且被YTHDF1识别,进而促进其翻译效率。同时,使用组织蛋白酶的抑制剂可以有效增强野生型DC细胞的交叉呈递能力。
研究人员进一步在其小鼠肿瘤模型中发现,YTHDF1敲除小鼠携带的肿瘤中PD-L1基因表达具有明显上调。PD-L1阻断疗法在YTHDF1敲除小鼠的治疗效果亦有大幅提升。结肠癌病人样本中的研究结果与小鼠模型相一致:肿瘤基质细胞中YTHDF1表达较低的肿瘤样本中含有较多的T细胞浸润。