2021年2月1日,山东大学药学院姜新义教授团队在 Nature 子刊 Nature Nanotechnology 杂志发表了题为:Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection 的研究论文。该研究构建了一种可注射的仿生纳米免疫调节剂-水凝胶超结构递药系统,并成功应用于IDH1突变型恶性胶质母细胞瘤的术后免疫治疗。
该水凝胶系统一方面可增加T细胞的激活和脑内招募;另一方面可调控氨基酸代谢消除Treg细胞的抑制作用,从而重塑“热肿瘤”杀伤免疫微环境阻止术后胶质瘤的复发。

免疫治疗为癌症治疗带来了前所未有的改变和希望,FDA已批准PD-1/PD-L1及CTLA4等多款单抗药物用于多种恶性肿瘤的临床干预和治疗,并获得令人满意的疗效。
然而,目前尚没有针对恶性脑肿瘤尤其是多形性神经胶质母细胞瘤(GBM)成功的免疫治疗方案。
神经胶质母细胞瘤(GBM)的肿瘤微环境高度复杂,多重因素限制了GBM免疫治疗策略的开发,其中细胞毒性T细胞匮乏和免疫抑制型细胞(如Treg)聚集是制约GBM免疫治疗的主要因素之一。
根据WHO对GBM的新分型标准,GBM分为IDH野生型、IDH突变型和NOS型,其中90%以上GBM IDH突变为IDH1型突变。IDH1和IDO1是两种典型的与免疫抑制相关的生物标志物,通过深入的生物信息学分析和数据挖掘,研究者发现两者mRNA在GBM患者肿瘤组织中均呈现高表达,而且两者均表现出与患者生存期负相关性。通过GBM患者临床样本分析,研究者进一步确证了肿瘤组织IDH1和IDO1的表达水平明显高于癌旁正常脑组织。

IDH1突变可下调IFN-γ诱导型趋化因子CXCL10,从而降低对活化T细胞的招募,导致活化T细胞不能高效进入中枢神经系统。IDO1可促进色氨酸向犬尿氨酸的转变,增加免疫抑制型Treg细胞在肿瘤组织的聚集。通过沉默IDO1调控肿瘤氨基酸代谢,可缓解Treg细胞相关的免疫抑制作用。
鉴于此,山东大学药学院姜新义教授团队在自组装寡肽水凝胶和仿生纳米免疫调节剂基础上构建了一种可原位重塑肿瘤免疫微环境的纳米免疫调节剂-水凝胶超结构递药系统。
该系统具有优良的生物相容性、可注射性、驻留性和药物贮库功能,可无缝衔接现行的临床手术治疗方案,通过多种途径级联重塑肿瘤杀伤的免疫微环境遏制术后GBM的复发。
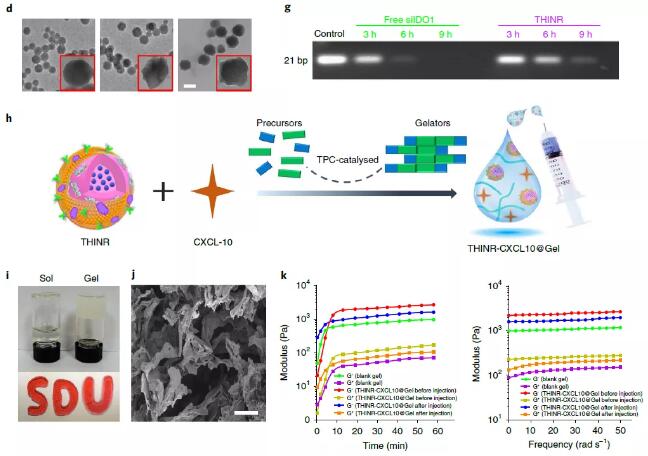
小胶质细胞对脑肿瘤细胞具有天然的趋化作用,其数量超过胶质瘤中其他各类免疫细胞数量的总和,是脑肿瘤组织中较多的细胞之一。
本研究中作者通过对肿瘤相关小胶质细胞/巨噬细胞仿生构建了具有肿瘤归巢作用的纳米免疫调节剂用于追踪定位脑肿瘤微小迁移灶并触发肿瘤细胞免疫原性死亡,产生肿瘤相关抗原,增加T淋巴细胞的激活;利用水凝胶贮库对趋化因子CXCL10的缓释作用,实现了活化T细胞向中枢神经系统的募集;通过沉默IDO1调控肿瘤细胞氨基酸代谢克服Tregs相关的免疫抑制,进一步放大了该肿瘤杀伤的免疫反应。
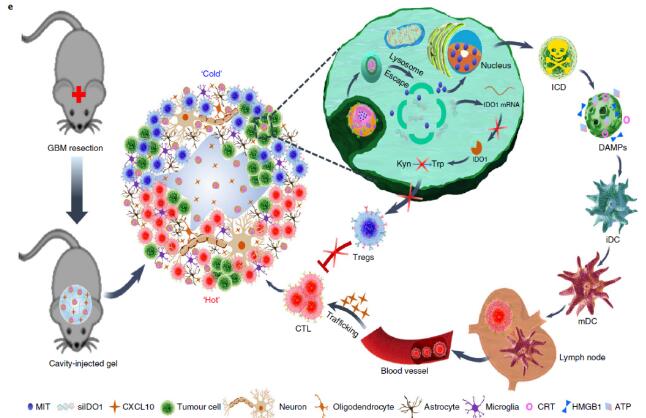
总的来说,姜新义教授团队从临床实践出发,以脑肿瘤临床治疗问题为导向,利用大数据深入挖掘脑肿瘤基因库数据潜在线索,提出立论假说,从分子水平、细胞水平和动物组织水平论证了该仿生纳米免疫调节剂-水凝胶超结构递药系统诱导免疫原性死亡,激活和招募T淋巴细胞,沉默IDO1解除Treg细胞免疫“刹车”的功能和效率,阐明了该系统重塑“热肿瘤”免疫微环境遏制GBM术后复发潜在的免疫学和分子生物学调控机制,为IDH1突变型GBM患者术后免疫治疗提供了有力的理论依据和实验参考,对其他“冷肿瘤”的术后免疫治疗也具有一定的借鉴意义和启示作用。
据悉,目前研究团队就该研究成果已申请中国和PCT专利,正深入探索和开发该水凝胶系统的临床应用,以期为恶性肿瘤的术后治疗提供新策略。
山东大学药学院研究生张晶、陈晨为该论文共同第一作者,山东大学药学院姜新义教授为通讯作者。
关于胶质母细胞瘤
胶质母细胞瘤(Glioblastoma,GBM),是常见、致命和难以治疗的成人脑肿瘤(之一)。外科手术切除肿瘤,然后进行放射治疗和替莫唑胺给药治疗,是目前的治疗方案,但该方案仅能改善患者的整体生存率。胶质母细胞瘤患者目前的中位生存期仅为18个月,平均五年生存率低于5%。
文章来源: 生物世界