近日,西湖大学生命科学学院郭天南课题组与合作团队(华中科技大学同济医学院附属协和医院胡豫、夏家红、聂秀团队)在Cell在线发表了题为“Multi-organ Proteomic Landscape of COVID-19 Autopsies”的新研究论文,报道了2020年初因新冠肺炎去世的患者体内多器官组织样本中蛋白质分子病理全景图。相当于他们将医生在显微镜下看到的人体感染新冠后细胞组织的改变放大了数万倍,达到蛋白质分子层面,“看”清楚是哪些分子的改变导致人体器官的病变和衰竭。
这是从蛋白质分子水平上,对新冠病毒感染人体后多个关键器官做出的响应进行了详细和系统的分析,为临床工作者和研究人员制定治疗方案、开发新的药物及治疗方法提供了线索和依据。
论文原文链接:https://www.cell.com/cell/fulltext/S0092-8674(21)00004-0

感染新冠病毒后,5336个蛋白质分子发生改变
大量临床诊疗和研究显示,新冠病人的肺部等器官产生了损伤。但此前大多数与新冠相关的基础研究,是在实验室里利用基于病毒感染的细胞系模型来推测病毒对人体各器官造成的影响,缺乏对新冠肺炎重症患者多器官损伤的病理学观察表型背后的分子水平研究,这样就很难深刻认识新冠致死的机理,并进一步针对患者进行精准的干预治疗。
西湖大学郭天南团队及其合作者收集了19例新冠去世患者的肺、脾、肝、心脏、肾脏、甲状腺和睾丸等七种器官的(图1)组织样本。通过镜下的病理学检查,可以发现这些病人的肺部出现弥漫性肺泡损伤,肺纤维化,中性粒细胞浸润及血栓形成等病理改变,脾脏白髓萎缩,肝脏发生脂肪化生和部分病例出现梗死,心脏发生心肌水肿及间质淋巴细胞浸润现象,肾脏发现急性肾小管损伤。
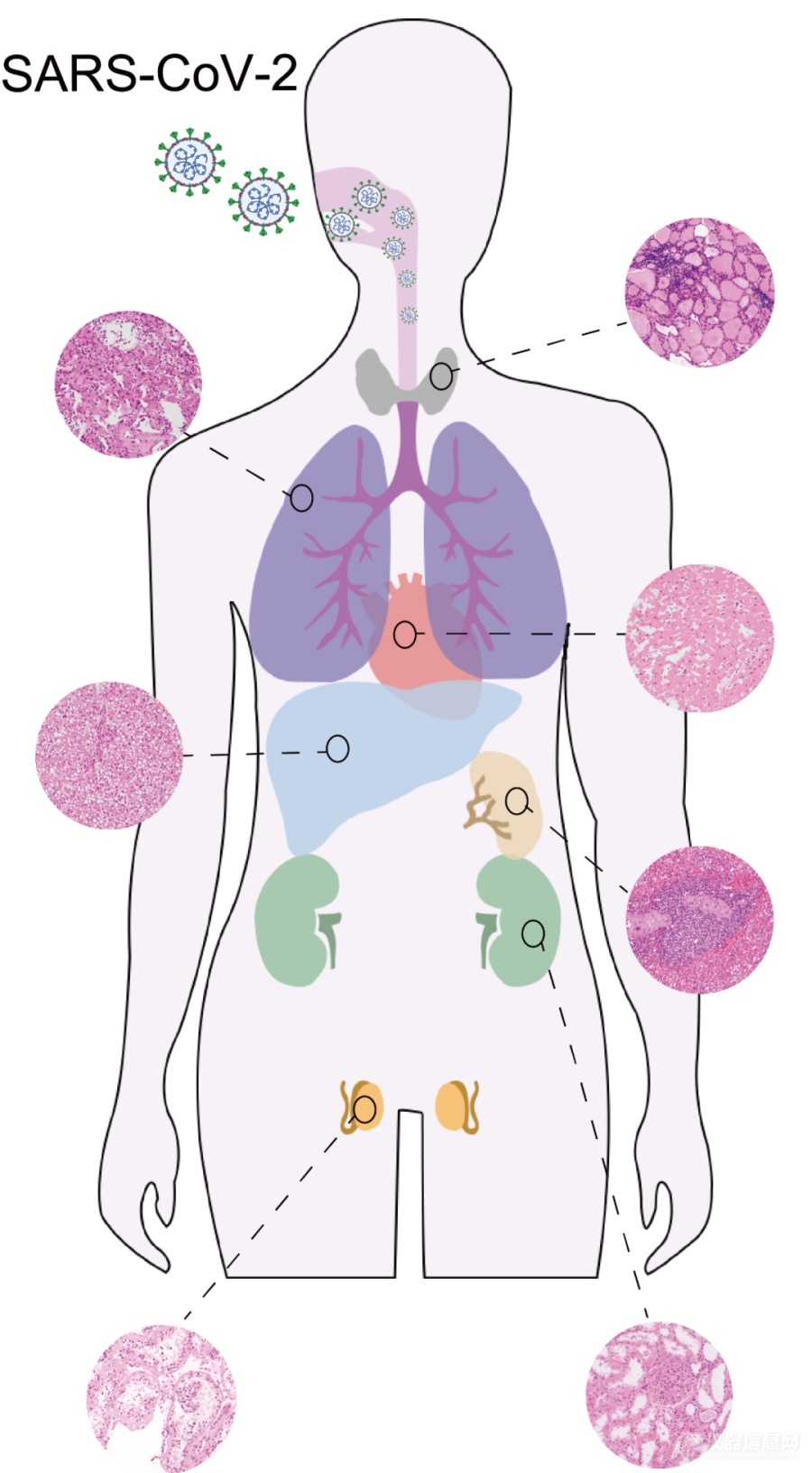
图1. 新冠病人多器官样本采集和镜下病理学检查
之后,分子层面的研究开始了。基于高压循环技术(PCT)及TMT标记结合鸟枪法蛋白质组技术的质谱数据采样以及组学数据分析,研究团队鉴定了11394个人源蛋白质分子,绘制出新冠危重症死亡患者的多器官蛋白分子全景图(图2)。与非新冠患者的对照组织样本比较,5336个蛋白质发生了改变(图3)。
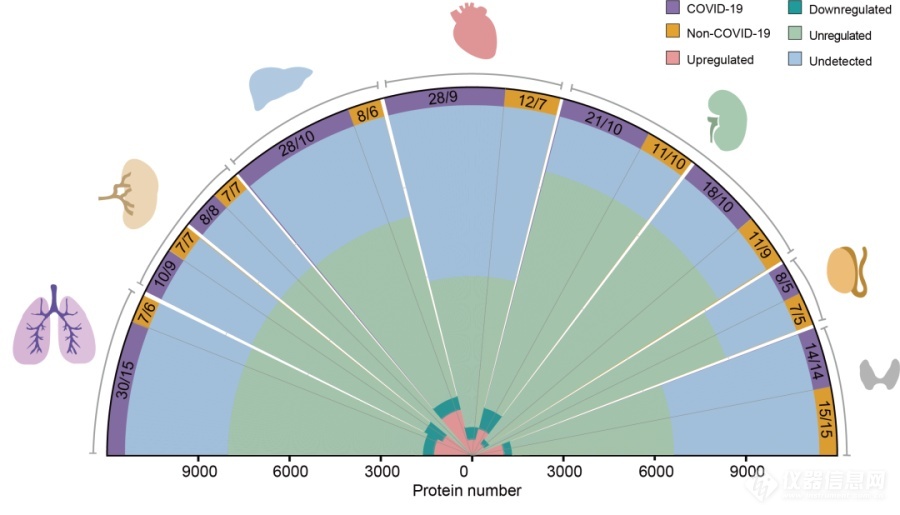
图2. 新冠病人多器官蛋白质组定量示意图
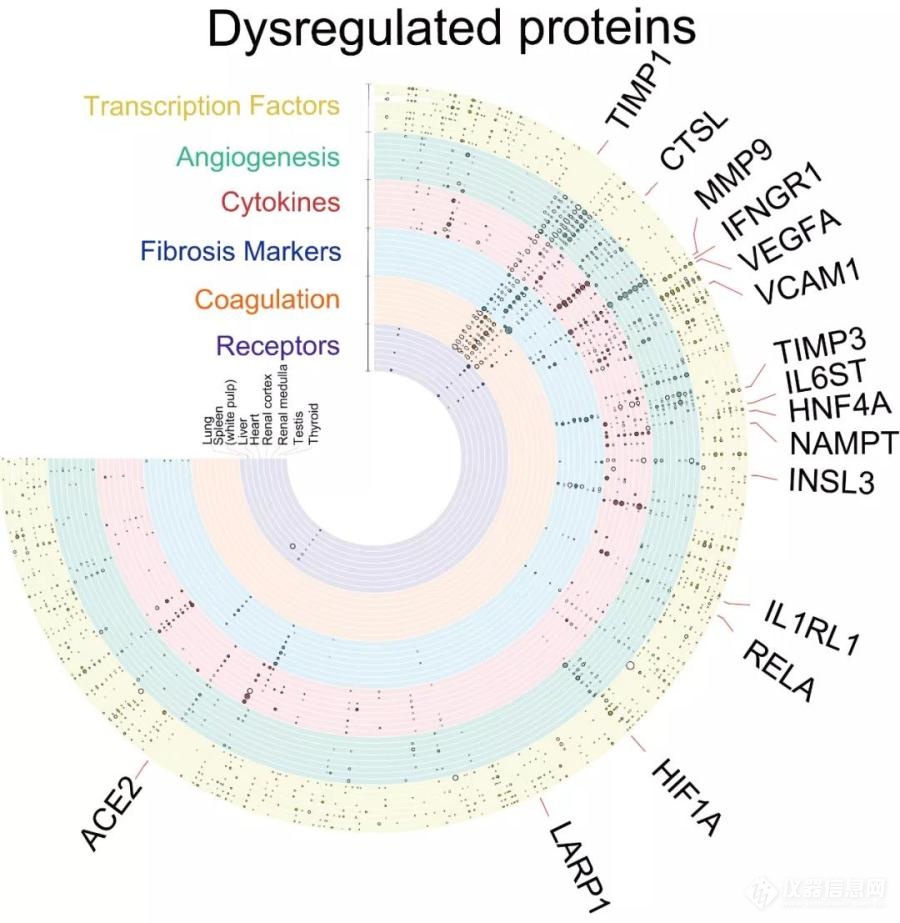
图3. 新冠病人死亡患者多器官蛋白分子病理全景图
其中,在人体七类器官组织中,脾脏红髓里未鉴定到明显改变的蛋白,而肝脏里改变的蛋白数量较多(N=1970),这意味着新冠肺炎致死患者中肝脏受到的损伤可能比较大。
对新冠病毒进入人体的“罪魁祸首”ACE2蛋白(病毒受体血管紧张素转化酶2,人体内调解血压的一个蛋白),研究团队发现它的数量在新冠病人各类器官中与非新冠病人并无显著差别。而另一个蛋白,即帮助病毒进入细胞相关的组织蛋白酶L(CTSL),在新冠病人肺部却明显增多(图4)。这提示ACE2的表达水平并没有在新冠致死患者中出现改变,仅仅是新冠病毒进入人体的一个通道,CTSL却可能是阻断病毒入侵的潜在治疗靶点。
除了肺部,肝肾也出现纤维化先兆
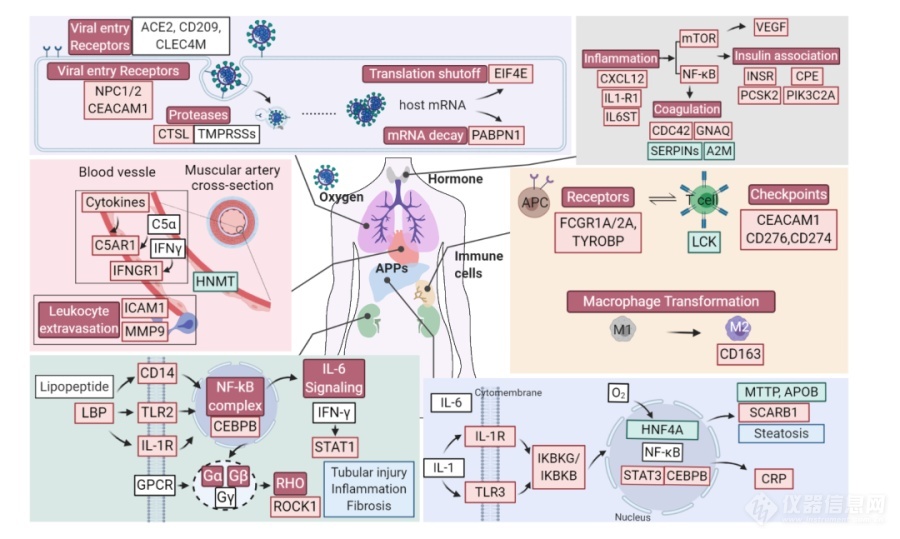
图4. 病毒侵入人体后多器官高炎症状态及组织损伤相关特异性分子变化示意图。其中红/绿框黑字分别表示明显上/下调的蛋白,红/绿框白字表示明显激活/抑制的通路,白框表示未定量或未失调的蛋白。
研究团队进一步对多种器官的生理功能、病理形态与蛋白质组学进行系统比较研究(图4),发现了多个肺部蛋白出现改变,包括与病毒增殖相关、参与肺纤维化病理过程及降解病毒限制因子的蛋白。蛋白组学同时显示,肺部和脾脏表现出以免疫检查点蛋白的上调及T细胞富集蛋白的下调为分子特征的适应性免疫反应抑制,且脾脏的T,B等淋巴细胞减少也印证了该分子特征。
从临床病理学来看,虽然只有肺部发生了实质性的纤维化病变,但蛋白组学结果(图3,4)显示,在肝脏、肾脏等器官也观察到组织纤维化的先兆,提示对已恢复健康的危重症新冠病人而言,需要对“多器官纤维化”这一可能出现的后遗症进行预防和采取提前干预。
研究团队中的临床合作者在2020年5月曾报告新冠病毒感染死亡患者的睾丸存在生精小管损伤,Leydig细胞减少和轻度淋巴细胞炎症等病理改变。但这些都只停留在“宏观”层面,究竟是哪些分子的改变导致了这些损伤?郭天南实验室找到了新冠患者的睾丸组织中发生明显改变的10个蛋白,它们的功能与胆固醇合成抑制、精子活性降低和Leydig细胞特异标记物减少紧密相关(图5)。其中Leydig细胞与男性雄性激素合成及分泌紧密相关,提示男性新冠患者的生育能力可能受到影响。
当然,这些研究是基于新冠死亡患者的组织样本,在轻症及重症患者中是否会出现同样变化,以及这样的变化是否可逆,还需要进一步研究。
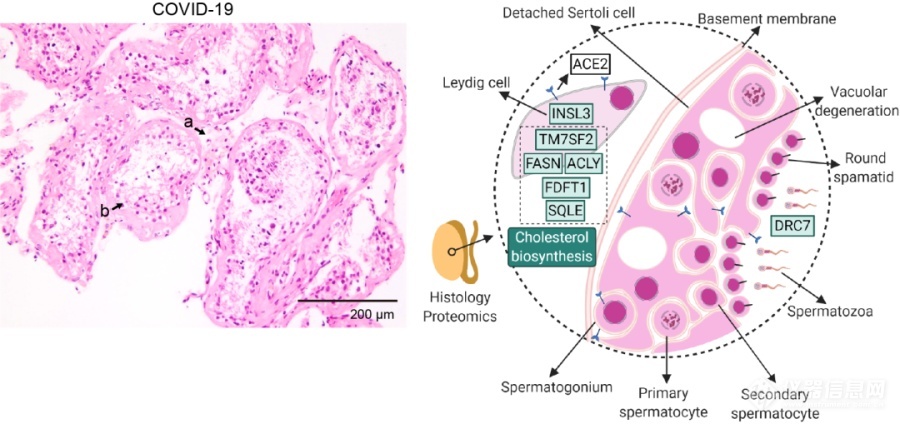
图5. 新冠去世患者睾丸间隙Leydig细胞相对减少,组织内明显下调的蛋白及相关通路示意图。
西湖大学郭天南特聘研究员、武汉协和医院胡豫教授、夏家红教授和西湖大学朱怡副研究员为该研究论文的共同通讯作者。武汉协和医院聂秀教授、郭天南课题组博士生钱鎏佳和孙瑞、协和医院黄博和董小川、郭天南课题组科研助理肖琦,以及西湖欧米(杭州)生物科技有限公司的张秋实为共同第一作者。
研究团队介绍:

郭天南,2006年毕业于华中科技大学同济医学院临床医学七年制,同时获得武汉大学生物科学双学位。2007-2008年曾在新加坡国立肿瘤中心从事医学研究工作。2012年获得新加坡南洋理工大学博士学位。2012-2017在瑞士苏黎世联邦理工大学Ruedi Aebersold教授实验室从事博士后研究。2017年初至七月在澳大利亚悉尼大学儿童医学研究所ProCan任Scientific Director,肿瘤蛋白质组Group Leader,悉尼大学医学院兼聘高级讲师。2017年8月加入浙江西湖高等研究院(西湖大学前身)任特聘研究员。
实验室主页:Guomics Laboratory of Proteomic Big Data