具有医学价值的多糖在和蛋白结合之前需要进行活化和衍生,最早采用溴化氰活化多糖的方法,用作和各种配体进行结合。这种方法对蛋白质的构象及性质会产生一定的影响,因此,使用受到一定的限制。氰基硼氢化钠还原法是蛋白质固化的新方法,其使用条件比较温和,对蛋白质天然属性的影响较小或没有影响。为了保证疫苗的使用安全,多糖和蛋白结合原液经纯化后,对总氰化物的残留有限值要求,其使用液中总氰化物的含量必须小于5ng/mL。
而采用药典中氰化物的检测方法,因为蛋白的干扰产生假阳性结果,无法获得有效数据。本文建立了紫外消解-气膜扩散法检测疫苗样品中总氰化物的新方法。该方法是USEPA认可的方法ASTM 7511-09方法,通过紫外消解,在线气膜扩散等技术手段,将总氰化物从复杂基体中分离出来,有效的克服了基体干扰,以更高的精密度检测更低浓度的氰化物。
实验部分
实验设备和试剂
FS 3700氰化物分析系统,由24通道蠕动泵,3090自动进样器,安培检测计,紫外消解器,WinFlowTM软件控制和处理系统,总氰化物分析模块组成。

图1 FS 3700氰化物分析系统
试剂配制如下:
载液:18.2 MΩ去离子水
接收液:0.1mol/L NaOH
TA1和TA2试剂:量取55mL浓硫酸于800mL去离子水中,添加20mL次磷酸,并用去离子水定容至1L。
检测方法
方法原理及流路图
ASTM 7511-09方法通过如下的步骤测量总氰化物。首先,液体样品被吸入并注入到一个酸性的载液流中,经紫外光照射,以分解金属氰络合物形成氰化物离子。在酸性条件下氰化物离子生成氰化氢(HCN)气体,并通过一片疏水性的气体扩散膜(GD)扩散进入碱性吸收液中,转变为氰化物离子(CN-)。该氰化物离子通过安培检测器(AMP)进行测量。图2 显示了总氰化物的流路图。
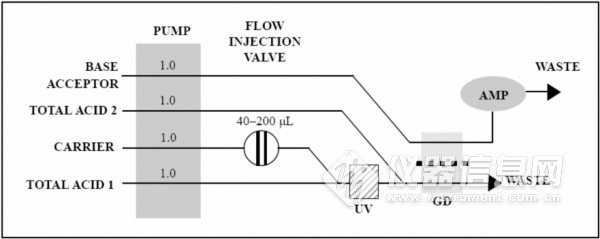
图2 流动注射分析总氰化物流路图
仪器条件及参数设置
取样时间为35s;进样体积为200μL定量环;40%泵速;进样循环时间为120s;六通阀切换时间为35s;检测器信号采集频率为1Hz。
结果和讨论
工作标准曲线
配制0,10,20,40,60,80,100ppb浓度范围标准曲线,以峰高做积分,一次线性相关系数为R2=0.9993,标准曲线和谱图如图3,图4所示。
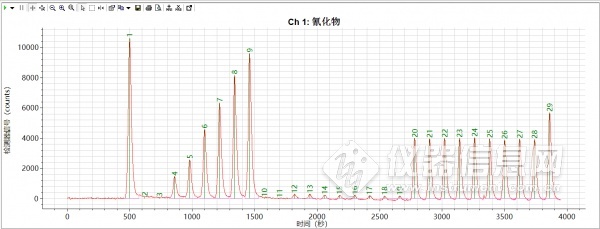
图3 0-200ppb标准曲线谱图
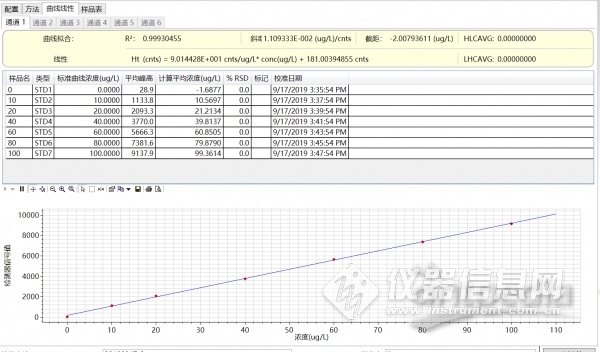
图4 0-100ppb标准曲线
样品检测结果
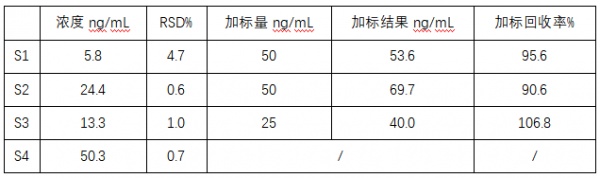
采用本方法检测三个样品,并加标回收,其结果列于表2和表3,其中S1为流感疫苗样品,S2为流脑疫苗样品,S3为结合原液经2倍稀释,S4为51mg/mL标准溶液经1000倍稀释。实际样品检测结果具有很好的重现性和加标回收结果。
结 论
ASTM 7511-09方法检测总氰化物,试剂配制安全简单,样品检测快速准确,采用膜扩散技术可以有效屏蔽蛋白的干扰,采用酸化和紫外消解获取氰离子,是检测多糖蛋白结合疫苗中氰基硼氢化钠残留的有效手段。