
新冠病毒灭活疫苗在非人灵长类动物中的免疫原性和保护效果
新冠病毒灭活疫苗的特征描述
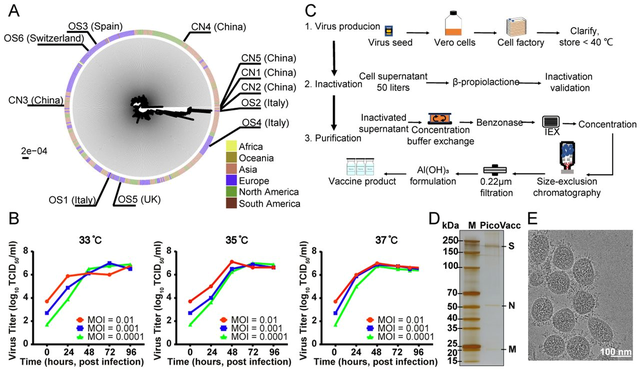
研究者从11名感染了新冠病毒的住院患者(包括5名重症监护患者)的支气管肺泡灌洗液中分离出多个新冠病毒毒株,其中5株来自中国,3株来自意大利,1例来自瑞士,1例来自英国,1例来自西班牙。这11个毒株广泛散在分布于基于所有可用序列构建的系统发育树上,在一定程度上代表了正在流行的病毒种群。
在此基础上,研究者选择CN2毒株用于疫苗制备,开发了一种纯化的灭活新冠病毒候选疫苗,并进行了中试生产。该疫苗在小鼠、大鼠和非人灵长类动物中均可诱导新冠病毒特异性中和抗体产生。这些抗体能有效地中和所选的其他10株(CN1、CN3-CN5和OS1-OS6)具有代表性的新冠病毒毒株,表明它们对世界范围内广泛流行的新冠病毒毒株都可能有潜在的中和能力。
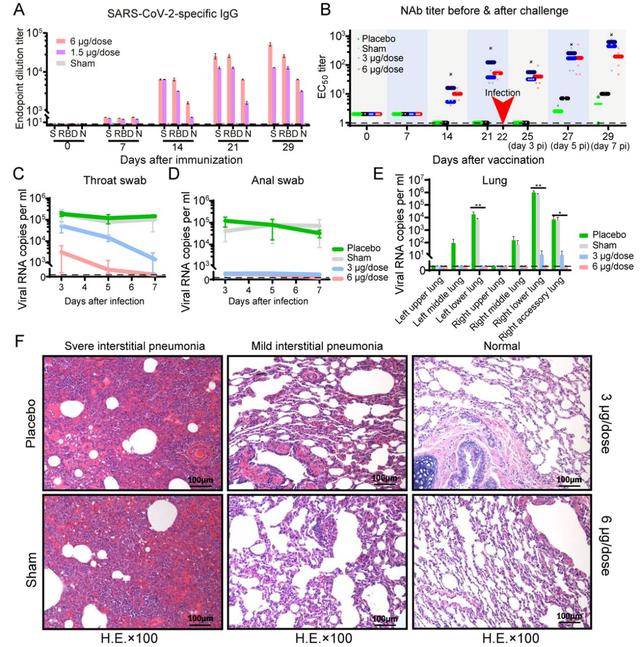
为评价疫苗的免疫原性,研究者在第0天和第7天分别给小鼠接种不同剂量的候选疫苗后,未观察到炎症或其他不良反应,新冠病毒的S蛋白和RBD特异性的免疫球蛋白在免疫后小鼠的血清中迅速产生,并于第6周达到滴度峰值。RBD特异的免疫球蛋白在S蛋白诱导产生的抗体中占一半,提示RBD是主要的免疫原,这也与恢复期患者的血清学特征非常相似。与恢复期患者血清相比,该疫苗诱导出了更高滴度的S蛋白特异性抗体。
接下来,研究者使用微量中和试验测定新冠病毒特异性中和抗体在一段时间内的水平。结果显示,高剂量免疫的中和抗体在初免后第1周出现,在第2周加强免疫后显著增加,在第7周达到峰值,而对照组则未检测到新冠病毒特异性抗体反应。研究者在大鼠中以及对不同毒株的实验中也得到了相似的结果。
随后研究者在疫苗免疫后的恒河猴中进行了攻毒实验以评价疫苗免疫原性和保护效果。研究者在第0、7和14天给恒河猴接种不同剂量(3微克和6微克)的疫苗,结果显示,S蛋白特异性的免疫球蛋白和中和抗体均在第2周被诱导出来,并在第3周继续增加,抗体滴度与恢复期的新冠患者的血清中的抗体滴度相似。
之后,研究者在第22天进行攻毒。结果显示,与对照组相比,疫苗免疫后的恒河猴肺部组织病理变化显著减小,病毒载量也显著下降。高剂量组的4只恒河猴感染后的第7天,咽喉、肛门和肺部都未检测到病毒,也没有观察到抗体依赖的增强现象。中剂量组感染后第7天咽部、肛门和肺部标本中能部分检测到病毒,但与对照组相比病毒载量降低了约95%。结果表明,接种6微克剂量候选疫苗后可以对新冠病毒攻毒提供完全的保护,3微克剂量的疫苗有部分保护作用。
研究者又通过观测临床指标和生化指数来验证该疫苗的安全性。他们发现,所有接种疫苗的恒河猴均未发现发烧和体重减轻现象,且食欲和精神状态都保持正常。在血液和生化分析方面,接种了疫苗的恒河猴的淋巴细胞亚群比例(CD3+、CD4+和CD8+)以及关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5和IL-6)与对照组相比均没有显著变化。此外,第29天对接种疫苗恒河猴的肺、心、脾、肝、肾和脑在内的各种器官组织的病理学评估表明,该疫苗也没有引起显著的病理学特征,以上结果表明候选疫苗在恒河猴中具有安全性。
记者了解到,基于上述研究结果,国家药品监督管理局已于2020年4月13日批准科兴控股生物技术有限公司旗下北京科兴中维生物技术有限公司(“科兴中维”)研制的新型冠状病毒灭活疫苗克尔来福
进入临床研究,Ⅰ/Ⅱ期临床研究于4月16日在江苏省徐州市睢宁县正式启动。
科兴中维新型冠状病毒灭活疫苗研发大事记
4月13日,科兴控股生物技术有限公司对外宣布,国家药品监督管理局已于4月13日批准旗下北京科兴中维生物技术有限公司研制的新型冠状病毒灭活疫苗克尔来福进入临床研究。这是北京企业第一支获准进入临床试验的新冠病毒灭活疫苗。
据介绍,科兴中维从3月13日起先后向国家药监局药品审评中心(CDE)滚动提交了17轮申报资料,药学、药理毒理、临床审评员和项目管理人员加班加点进行审评与协调,切实践行了“研审联动,同步审评”要求,极大推动了项目进程。
4月10日晚上10:00左右,新冠灭活疫苗项目课题负责人,科兴控股董事长、总裁兼CEO尹卫东代表课题组向以钟南山院士为组长的联防联控机制科研攻关组的大专家组汇报了新冠灭活疫苗临床前研究工作及临床研究方案并回答了专家组的提问。
中国医学科学院医学实验动物研究所的科学家团队在此期间根据审评中心要求紧锣密鼓地按时提交各项研究评价报告。
4月12日11:30,科兴中维向CDE正式提出临床试验申请。
4月12日18:30,CDE召开专家审评会,科兴中维总经理高强作为新冠灭活疫苗研发负责人向以王军志院士为组长的审评专家组汇报了新冠灭活疫苗临床前研究工作及临床研究方案。随后CDE连夜无休,在接下来的10多个小时内高效完成了多环节多步骤的审评工作。
记者了解到,科兴中维研制的新型冠状病毒灭活疫苗系用新型冠状病毒(CZ株)接种Vero细胞,经病毒培养、收获、灭活、纯化和铝吸附制成,不添加防腐剂和生物保护剂。目前临床试验用新冠灭活疫苗已通过中国食品药品检定研究院检定,临床试验将很快启动。科兴将按照国家药监局的要求,严格遵守GCP及相关法规实施临床试验。
2003年-2004年,科兴在国家有关部门支持下与中国医学科学院医学实验动物研究所、中国疾控中心病毒所等单位合作开展了SARS冠状病毒灭活疫苗研制工作,确定了疫苗的制造检定规程并完成了Ⅰ期临床试验,并在接下来的16年中承担了多个国家重大专项课题,先后针对人感染高致病性禽流感(H5N1)、甲型H1N1流感和EV71所致手足口病等新发、突发传染病开展了疫苗研制和相关研究。以秦川教授为首的中国医学科学院医学实验动物研究所团队、香港大学及科兴还协同合作,共同完成了“人类重大传染病动物模型体系的建立及应用”项目(荣获2019国家科学技术进步奖二等奖),这些都为加快新型冠状病毒疫苗研制奠定了重要基础。
科兴中维新型冠状病毒灭活疫苗研发大事记

北京时间5月6日晚8时30分,中国驻墨西哥大使馆与上海市外办联合组织抗击新冠肺炎疫情视频连线会,请来中国-WHO联合专家考察组成员、上海市新冠疫情防控领导小组专家组成员、复旦大学医学院副院长吴凡,上海新冠肺炎医疗救治专家组组长、复旦大学附属华山医院感染科主任张文宏出席。
有墨西哥专家提问,疫苗研究在早期、中期还是晚期阶段?
张文宏表示,全世界有180个疫苗在进入研究,美国有2个疫苗进入三期临床研究,中国有2个疫苗进入二期临床研究。
按照目前三期临床研究的时间表和中国二期临床研究的时间表,世界上最早的疫苗结果公布时间,应该在今年年底或者明年年初1月左右。如果所有数据理想,能够申报美国FDA或中国CFDA的通过,应该在明年3月到6月之间。
“现在如果对于疫苗有过高的期待,我认为也是不恰当的。”张文宏同时表示,这些疫苗的有效性现在不能预测,因为现在二期临床研究得出来的都是抗体的水平,所有的结果都要在发病率比较高的地区的三期临床研究,才能最终得出来。
在未来的一年到两年时间里,我们可能会有比较有效的药物和疫苗出现。目前还要以防控和病情的救治为主。