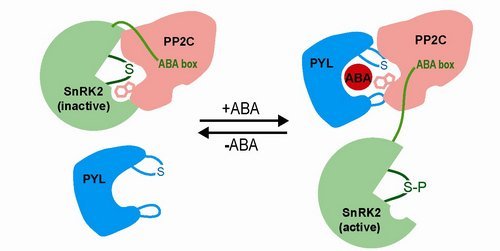
ABA的信号通路是通过受体激活下游激酶的,在没有ABA的情况下,激酶是被磷酸化酶抑制的。此次发表的两篇文章分别解决了激酶如何被抑制以及如何被激活的两个关键科学问题。
在Science文章中,研究人员报道了激酶和磷酸酶的复合体结构,从中发现激酶与ABA受体对磷酸化酶的识别有惊人的相似性。ABA受体的作用位点是在PP2C的活性中心。激酶和磷酸酶的复合体结构揭示了激酶的活性中心与PP2C的活性中心相互对接,从而模拟了受体-PP2C的相互作用。这些结构生物学的研究结论提出了一个简单的新机制,即耦合的ABA受体能直接抑制磷酸化酶并激活激酶。同时,这也揭示了激酶-磷酸化酶通过催化位点的相互作用而进行彼此调控的新法则。
在PNAS文章中,研究人员报道了调控ABA信号通路激酶的自身激活机制。通常激酶要通过上游激活因子被激活,而调控ABA的激酶则不同,它具有高水平的自我激活能力。研究人员的结构发现,调节ABA的激酶具有一个特有的螺旋结构来固定激酶的三维结构,从而维持激酶的自我磷酸化活性。结合ABA受体—PP2C复合体结构,该研究详实地解析了ABA激素如何抑制PP2C从而激活调节aba信号通路的激酶,从而为ABA信号通路的核心结构提供一个完整的解析。