资料结果显示,在53名来自美国、欧洲、加拿大及日本的严重和危重新冠肺炎患者中,瑞德西韦(Remdesivir)给68%(36人)的患者带来临床改善。

其中57%(30/53)接受机械通气的患者中有17例已拔管。共有47%(25/53)的患者出院,13%(7/53)患者死亡;在接受有创通气的患者中,死亡率为18%(6/34),而未接受有创通气的患者为5%(1/19)。
据了解,这53名患者都是在同情用药情况下接受瑞德西韦治疗的。按照治疗计划,他们将接受为期10天的瑞德西韦治疗,随后是18天的随访期。这一研究发布的数据截至2020年3月30日。
在安全性方面:
共计32名患者(60%)出现副作用,最常见的是肝脏酶指标升高、腹泻、皮疹、肾功能障碍和高血压。
总计12名(23%)患者出现严重副作用,其中包括多器官多器官功能障碍综合征、败血性休克、急性肾脏损伤和高血压。
还有7名在完成瑞德西韦治疗后死亡,其中包括6名接受有创通气的患者和1名接受无创氧气支持的患者。
从吉利德发布的内容显示,他们已经获悉,由于入组人数低,瑞德西韦在中国进行的针对重症患者的研究已提前中止。
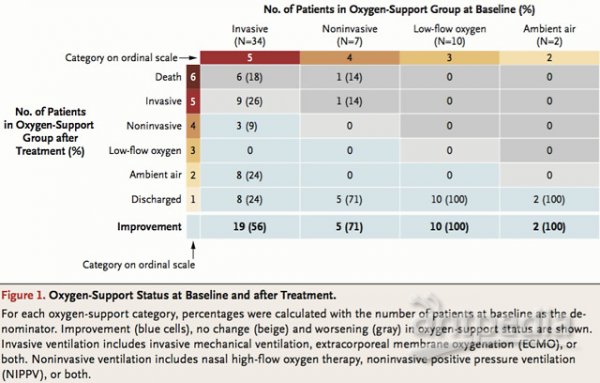
该论文作者指出,这项研究提供了瑞德西韦(Remdesivir)治疗重症患者的最新数据,68%的患者氧气支持得到改善,在中位随访时间为18天时的总死亡率为13%。此前,在中国进行的一系列研究中,重症患者的死亡率在17-78%之间。一项在武汉进行的包含201名患者的研究中,接受有创通气的患者的死亡率高达66%(44/67)。作者表示,与这些数字相比,13%的死亡率值得关注。
今年2月5日,吉利德已与中国卫生部门达成了协议,支持对2019-nCoV感染者开展两项临床试验,该试验由王辰、曹彬团队负责,计划于4月27日结束。其中一项研究评估瑞德西韦(Remdesivir)用于确诊感染2019-nCoV且已住院但未表现出显著临床症状(如,需要额外吸氧)的患者的治疗效果,另一项研究则评估瑞德西韦(Remdesivir)用于出现较严重临床症状(如,需要吸氧)的确诊病患的疗效。
在此前的发布会上,国家知识产权局副局长何志敏表示,在武汉多家医院进行的瑞德西韦的临床试验,将于4月27日公布结果。“我们非常关切瑞德西韦的有效性、安全性,期待能够尽快出现一批包括瑞德西韦在内的,能对新冠肺炎治疗产生积极疗效的药品。”
4月5日,吉利德科学董事长兼首席执行官Daniel O’Day在公开信中表示,在过去的一周,吉利德一直在与监管机构协商,为瑞德西韦这个新型冠状病毒肺炎的潜在治疗药物建立更多的扩大可及方案。通过该方案,医院或医生能够在同一时间为多名重症患者申请紧急使用瑞德西韦。这些患者无法参加临床试验,然而,对他们、他们的家人和为他们提供治疗的医护人员来说,“紧急”是最真实的描述。
新冠肺炎暴发以来,瑞德西韦(Remdesivir)被视为最具潜力的在研药物,民间甚至将其称为“人民的希望”。此前世界卫生组织在中国考察疫情后表示,瑞德西韦(Remdesivir)可能是治疗新冠肺炎唯一有效的药物。今年1月,基于“同情用药”原则,美国研究人员对一名新冠病毒感染者使用了瑞德西韦,患者症状在一两天内显著改善,使这种药物备受瞩目。
吉利德强调,该公司必须采取负责任的、符合伦理道德的方法来确定瑞德西韦(Remdesivir)是否确实是一种安全、有效的治疗方案。按此前该公司披露的计划,它们将在4月初披露一些临床数据。
目前,患者可以通过以临床试验、同情用药等渠道获得瑞德西韦(Remdesivir)。
Daniel O’Day在上述公开信中指出,目前包括可供分发的成品以及处于最后生产阶段的在研药物在内,吉利德现有的瑞德西韦(Remdesivir)供应量共计为150万剂。吉利德正在无偿提供现有的药品用于治疗新型冠状病毒肺炎的重症患者。“这150万剂药品可用于临床试验、同情用药以及扩大可及方案,并将捐赠用于未来可能获得监管批准后的广泛使用。这些药品可通过每天在医院进行静脉注射给药,用于治疗有严重症状的患者。”