
当前,大多数COVID-19测试是使用病毒RNA提取,然后进行RT-qPCR扩增和检测SARS-CoV-2基因组的几个高度保守的区域之一,或通过检测对病毒蛋白具有特异性的血清抗体来进行的。但是,由于试剂和仪器的访问和供应问题的结合,使用这些方法进行测试的全球能力受到了限制。
更严重的是,许多受感染的人没有出现症状,不太可能进行检查,并且在不知不觉中助长了感染的传播。为了有效地降低SARS-CoV-2的传播,我们需要进行人口规模的测试,以便能够快速识别所有受感染的个体,确定关键的潜在爆发区域,以支持最大限度地提高人类健康水平的流行病学干预措施,同时减少限制性隔离措施的程度 。
当前,大多数COVID-19测试是使用病毒RNA提取,然后进行RT-qPCR扩增和检测SARS-CoV-2基因组的几个高度保守的区域之一,或通过检测对病毒蛋白具有特异性的血清抗体来进行的。但是,由于试剂和仪器的访问和供应问题的结合,使用这些方法进行测试的全球能力受到了限制。
在该研究中,提出了LAMP-Seq,这是一种条形码逆转录循环介导的等温扩增(RT-LAMP)方法,可以显著降低人口规模测试的成本和复杂性。在这种方法中,单个样品在单个加热步骤中进行处理,产生条形码码的扩增子,可以将其运送到测序中心,进行汇总和分析。对压缩的条形码空间中的每个样本使用独特的条形码组合可实现广泛的合并,从而显著降低成本和组织工作。鉴于下一代测序的低成本和可扩展性,研究人员相信使用现有的测序基础设施,该方法可以合理地扩展规模,每天可测序及分析数百万个样品。
韩国首次系统获得新冠病毒转录组及表观转录组学数据
SARS-CoV-2是导致COVID-19大流行的乙型冠状病毒。尽管最近报道了SARS-CoV-2基因组,但其转录组结构尚不清楚。
2020年4月8日,韩国基础科学研究所Dongwan Kim等人在Cell 在线发表题为“The architecture of SARS-CoV-2 transcriptome”的研究论文,该研究利用两种互补的测序技术,展示了SARS-CoV-2转录组和表观转录组的高分辨率图。

由于新病例的迅速增加,2019年冠状病毒病(COVID-19)很快引起了全球关注。新型冠状病毒感染被认为是从动物传播的,病原体被鉴定为SARS-CoV-2。到2020年1月,怀疑最初受感染的患者是通过人与人之间的传播感染了该病毒。自2020年1月以来,该病毒已迅速传播到中国大部分地区和其他国家。截至2020年4月8日,全球确诊病例累计超过140万例,死亡8万余例。这些数字每天都会更新,而且预计还会进一步增加。
冠状病毒携带所有RNA病毒家族中最大的基因组(26–32 kb)。每个病毒转录物均具有5'-cap结构和3'poly(A)尾巴。细胞进入后,基因组RNA被翻译以从两个开放阅读框(ORF),产生非结构蛋白(nsps)ORF1a和ORF1b。ORF1a产生多肽1a(pp1a,440-500 kDa),被裂解为11 nsps。-1核糖体移码发生在ORF1a终止密码子的紧邻上游,这允许ORF1b继续翻译,从而产生大多肽(pp1ab,740–810 kDa),被切割成16 nsps。蛋白水解切割由分别具有木瓜蛋白酶样蛋白酶结构域和3C样蛋白酶结构域的病毒蛋白酶nsp3和nsp5介导。
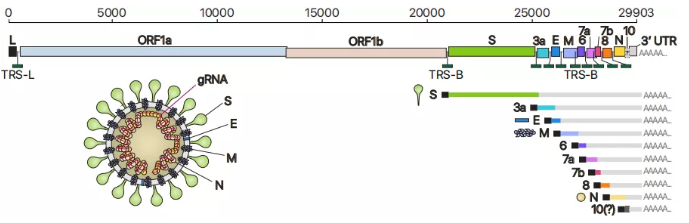
SARS-CoV-2基因组组织,规范的亚基因组mRNA和病毒体结构的示意图(图源Cell )
病毒基因组还被用作复制和转录的模板,由具有RNA依赖性RNA聚合酶(RdRP)活性的nsp12介导。 产生负义RNA中间体,以用作合成正义基因组RNA(gRNA)和亚基因组RNA(sgRNA)的模板。gRNA由结构蛋白包装以组装后代病毒体。较短的sgRNA编码保守的结构蛋白【刺突蛋白(S),包膜蛋白(E),膜蛋白(M)和核衣壳蛋白(N)】和一些辅助蛋白。根据当前注释,已知SARS-CoV-2具有六个辅助蛋白(3a,6、7a,7b,8和10)。但是ORF尚未通过实验验证其表达。 因此,目前尚不清楚该紧凑基因组实际上表达了哪些辅助基因。
每个冠状病毒RNA都包含约70 nt的5'“前导”序列,该序列与基因组下游部分的“主题”序列融合。根据相关的模型,前导序列-主体融合发生在负链合成过程中的短基元,称为转录调控序列(TRS),紧邻ORF。TRS包含一个保守的6-7 nt核心序列(CS),周围是可变序列。在负链合成过程中,RdRP在穿过体内TRS时会暂停(TRS-B),然后将模板切换到前导体中的TRS(TRS-L),这会导致转录不连续,从而导致前导-主体融合。从融合的负链中间体中转录出正链mRNA。已经在其他冠状病毒中研究了复制和转录机制。但是,尚不清楚一般机制是否也适用于SARS-CoV-2,以及SARS-CoV-2转录组中是否存在未知成分。为了开发诊断和治疗工具以及对这种新病毒的理解,定义SARS-CoV-2基因组的组织至关重要。
深度测序技术提供了研究病毒转录组的强大手段。诸如Illumina和MGI平台之类的“合成排序(SBS)”方法具有很高的准确性和覆盖范围。但是它们受到短读长度(200-400 nt)的限制,因此应通过计算重新组装片段化的序列,在此期间会丢失单倍型信息。最近引入的是基于纳米孔的直接RNA测序(DRS)方法。尽管纳米孔DRS的测序准确性受到限制,但它可以进行长读测序,这对于分析长的CoV转录本特别有用。此外,由于DRS可以检测RNA而不是cDNA,因此可以在测序过程中直接获得RNA修饰信息。已发现许多RNA修饰可控制真核RNA和病毒RNA。末端RNA修饰(例如RNA拖尾)在细胞和病毒RNA调节中也起着至关重要的作用。
在这项研究中,研究人员结合了两种互补的测序方法,即DRS和SBS。该研究明确地绘制了SARS-CoV-2的sgRNA,ORF和TRS。此外,研究人员发现了许多与常规TRS介导的聚合酶跳跃不同的非常规RNA连接事件。该研究进一步发现了RNA修饰位点,并测量了gRNA和sgRNA的poly(A)尾巴长度。
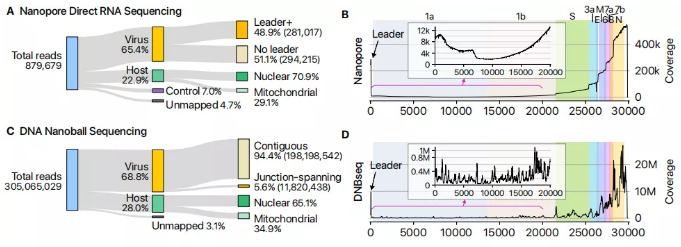
测序数据统计(图源Cell )
具体来说,该研究利用两种互补的测序技术,展示了SARS-CoV-2转录组和表观转录组的高分辨率图。 DNA纳米孔测序表明,由于许多不连续的转录事件,转录组非常复杂。除了典型的基因组RNA和9个亚基因组RNA,SARS-CoV-2还可产生编码未知ORF且具有融合,缺失和/或移码的转录本。
使用纳米孔直接RNA测序,该研究进一步在病毒转录本上找到了至少41个RNA修饰位点,具有最频繁的基序AAGAA。修饰的RNA比未修饰的RNA具有较短的poly(A)尾巴,表明修饰和3'尾巴之间存在联系。在这项研究中发现的未知转录本和RNA修饰的功能研究将为我们对SARS-CoV-2的生命周期和致病性的理解开辟新的方向。
陈化兰/步志高/武桂珍发现猫能感染新冠、狗不易感,是否传人不明确
SARS-CoV-2被认为起源于蝙蝠。但是,该病毒的中间动物来源是完全未知的。
中国农科院哈尔滨兽医研究所陈化兰,步志高及中国疾病预防控制中心病毒病预防控制所武桂珍共同通讯在Science 在线发表题为“Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS–coronavirus 2”的研究论文,该研究调查了雪貂和与人类密切接触的动物对SARS-CoV-2的易感性。结果表明,新冠病毒在狗、猪、鸡和鸭子中的复制能力很差,但在雪貂和猫身上能有效复制。该研究还发现,新冠病毒可通过呼吸道飞沫在猫之间传播。目前仍不明确猫能否将病毒传染给人类,因此猫主人尚无需恐慌。

研究人员将病毒注入5只家猫的鼻子中。6天后,当其中两只动物被安乐死时,在它们的上呼吸道中发现了病毒RNA和感染性病毒颗粒。
研究人员将已被感染的猫的笼子放在未接种病毒的猫的笼子旁边。一段时间后,他们在未接种病毒的猫检测到了病毒RNA。研究认为,SARS-CoV-2可通过空气中飞沫在猫之间传播。
作者指出,对猫体内病毒的监测应被纳入人类防控新冠肺炎疫情的举措当中。
一些科学家表示,这项发现是值得关注的,但猫主人现在不必惊慌。因为,感染病毒的动物能否将病毒传给人类,目前尚不清楚。
美国俄亥俄州立大学病毒学家Linda Saif说, 这些结果基于实验室实验得出,在实验中,有少数动物会被故意给予高剂量的SARS-CoV-2病毒,但并不代表在实际生活中会在人与宠物之间传播。
“没有直接证据表明被感染的猫的分泌物中有足够多的冠状病毒,可将冠状病毒传给人类。”Linda Saif说。
Linda Saif表示,没有一只感染的猫表现出了疾病的症状,且3只接触感染动物的猫中只有一只感染了病毒。这表明,该病毒在猫之间的传播率可能不高。此外,传播方式尚不清楚。研究中没有描述笼子是如何设置的,未受感染的猫可能从受污染的粪便或尿液中感染了病毒。
“还需要更多的测试,包括给猫注射不同剂量的病毒,看看它们是否能将病毒传给其他猫。”Linda Saif说。
香港大学流行病学家Dirk Pfeiffer认为,猫应被考虑在防控措施当中,但它们并不是传播疾病的主要因素,防控疫情无疑需要继续坚定地致力于降低人与人之间传播的风险。
此前,对引发严重急性呼吸系统综合征的SARS病毒的研究表明,猫可以被感染并传染给其他猫。但没有迹象表明病毒在家养猫中广泛传播,或者从猫传播给人类。
但是,美国疾病控制预防中心已给出建议,携带2019新型冠状病毒(COVID-19)的人应限制与宠物的接触,包括避免抚摸宠物、舔舐和分享食物。
1、病毒对狗的感染能力较弱
作者对5只3个月大的比格犬接种了SARS-CoV-2病毒。结果发现,即便是直肠拭子阳性的比格犬,在血液和其他组织器官中也无法检测到病毒。这一研究结果证明SARS-CoV-2对狗的感染能力较弱。
研究人员采用相同的策略测试了猪、鸡和鸭对SARS-CoV-2的易感性,结果均未检测到病毒,且血清呈阴性。这表明,猪、鸡和鸭对SARS-CoV-2不易感。
作者认为,猫和狗与人类有着密切接触,了解它们对SARS-CoV-2的易感性对于防控新冠肺炎疫情很重要。
“我们为新型冠状病毒的动物宿主和疫情防控中的动物管理提供了重要启示。”作者指出。
2、雪貂易感,可作疫苗药物开发的动物模型
雪貂通常被用作人类呼吸道病毒的感染动物模型,因此哈兽医研究团队测试了SARS-CoV-2在雪貂中的易感性。他们对雪貂进行鼻内接种SARS-CoV-2,并在4天后对其进行安乐死。
而后分别测定每只雪貂的鼻甲、软腭、扁桃体、气管、肺、心脏、脾脏、肾脏、胰腺、小肠、脑和肝脏等不同器官的病毒载量。结果表明,SARS-CoV-2可以在雪貂的上呼吸道复制,但无法在其他脏器中复制。
同时,值得注意的是,SARS-CoV-2可在雪貂体内复制长达8天而不会引起严重的疾病或死亡。
作者认为,SARS-CoV-2在雪貂上呼吸道高效复制的事实,可使雪貂成为测试潜在疫苗和药物的候选动物模型。事实上,雪貂已经被用作流感研究的模型,一些实验室已经开始利用它们进行COVID-19研究。