
在哺乳动物中,共有10个Cav通道,分为三个亚型:Cav1(Cav1.1-Cav1.4),Cav2(Cav2.1-Cav2.3)和Cav3(Cav3.1-Cav3.3)。Cav1通道,也称为L-型Cav或结合二氢吡啶(dihydropyridine)受体的DHPRs,包含多个亚基,包括成孔α1核心亚基,辅助亚基α2δ,β和γ。Cav通道的α1亚基包含2,000个氨基酸残基,折叠为4个同源重复序列I-V,每个重复包含六个跨膜区段S1-S6,形成经典的电压控制离子通道(voltagegated ion channel,VGIC)。每个重复中的S1-S4形成外围电压感应域(voltage sensing domain,VSD); 中心离子传导孔区域主要由S5和S6与选择性过滤器(SF)组成。
由于生理功能的重要性,Cav通道的异常调节或功能障碍与多种神经、心血管、肌肉和精神疾病相关。因此,Cav通道也是重要的药物研究靶标。目前市场上有三种主要类型的L型Ca2+通道拮抗剂应用于临床,分别是二氢吡啶(DHP),苯并噻氮(benzothiazepines,BTZ)和苯烷基胺(phenylalkylamines,PAA)。其中,DHP被广泛用于治疗高血压、心绞痛、早产等。作为BTZ和PAA的原型药物,diltiazem和verapamil广泛用于血管舒张、心绞痛治疗、高血压,以及某些心律失常和心动过速等。DHP拮抗剂主要通过变构效应起作用。拮抗剂有利于失活状态,而激动剂则导致L型Cav通道的长时间开放。但有趣的是,一些与DHP拮抗剂相似的化合物对L型Cav通道却表现出激动剂的作用,如(S)-(–)-Bay K 8644(图1)。
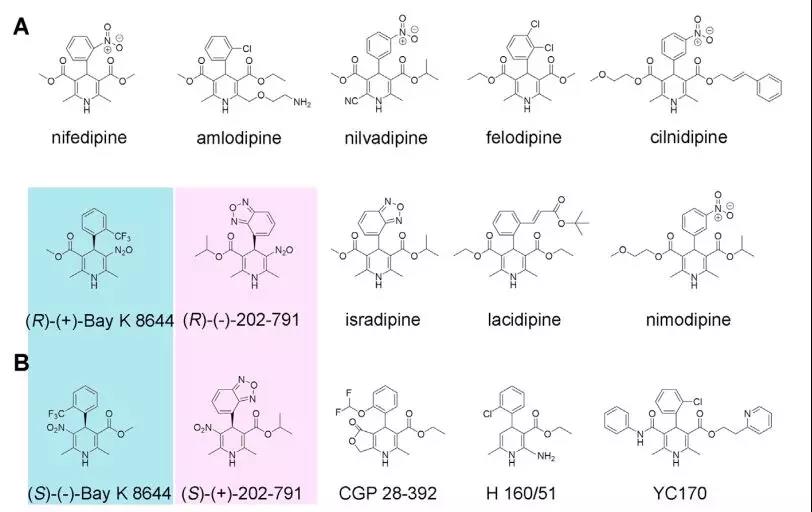
图1. 具有代表性的DHP拮抗剂(A)和激动剂(B)的化学结构
此前,有课题组解析了与几种DHP拮抗剂和verapamil结合、细菌来源的CavAb晶体结构。CavAb为同源四聚体结构,与真核单链Cav通道的亲缘关系相距甚远。尽管前人有很多对于此类激动剂和拮抗剂的机制做了研究,但是精确识别这些化合物的结构基础仍有待阐明。因此,解析与配体结合的Cav通道结构对于揭示DHP拮抗剂和激动剂的不同作用模式的分子机制研究是必需的。
在本实验室此前的基础上,通过使用cryo-EM技术,颜宁组解析了rCav1.1与DHP拮抗剂nifedipine(N)和激动剂Bay K 8644(B)结合的复合物结构,总分辨率分别为2.9 Å和2.8 Å (图2);rCav1.1与另外两种代表性BTZ和PAA原型药物,diltiazem(D)和verapamil(V)结合的复合物结构,总分辨率分别为3.0 Å和2.7 Å (图2)。
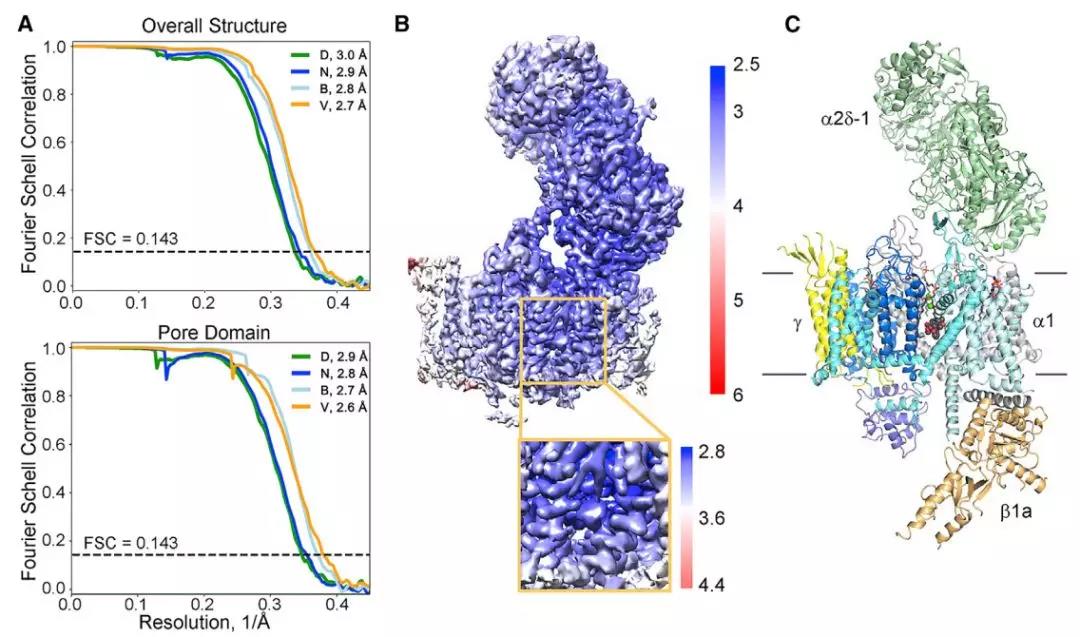
图2. 结合不同小分子的兔源Cav1.1结构分析。A. 分别结合nifedipine (N), Bay K 8644 (B), diltiazem (D), and verapamil (V)的Cav1.1 Cryo-EM Fourier shell correlation (FSC)曲线。 B. rCav1.1-N. Cryo-EM密度图。 C. 2.9 Å的rCav1.1-N Cryo-EM结构。
作者发现,结合了配体后,rCav1.1的结构会发生一定的构象改变。而对于以上的四种配体,结构上都有精确的识别机制。这些高分辨率结构的解析确信了BTZ和PAA药物是rCav1.1的核孔阻遏物,解释了两者的抑制效应。由于DHP小分子类似物既有拮抗剂效应,又有激动剂的效应,因此还需要更多结合这些小分子的不同状态的结构,才能完整的阐述相关的分子机制。总的来说,这些结构进一步在原子水平阐述了rCav1.1的分子基础,为临床研究、新药开发等提供了重要的参考价值。
这是颜宁课题组近几年来在离子通道蛋白研究中的又一重要突破。除了钙离子通道外,颜宁课题组还在钠离子通道、钠离子通道与配体等研究中取得过杰出的研究成果。