2019年4月11日,来自于苏黎世大学分子生命科学研究所的Johanna Wagner等在 Cell 发表题目为:A Single-Cell Atlas of the Tumor and Immune Ecosystem of Human Breast Cancer的文章。他们采用了单细胞蛋白组学研究的理念,通过质谱流式细胞技术(Mass Cytometry)的方法,检测了数千万个细胞,这些细胞分别来自于144例乳腺癌患者的肿瘤组织(基本覆盖所有临床亚型),46例癌旁组织和4例通过乳腺成形术得到的正常乳腺组织。结果表明不同乳腺癌患者肿瘤微生态系统存在明显差异,该差异与相应肿瘤患者的预后显著相关,基于上述结果在将来或许可以为临床治疗提供更优的精准治疗方案。

作者首先讲述了使用质谱流式细胞技术“绘制”人类乳腺癌肿瘤微生态系统图谱的实验方案(图1)。具体来说,作者在收集好相应的肿瘤组织和非肿瘤组织标本后,制备成单细胞悬液,对这些单细胞悬液标记了73种抗体后通过质谱流式细胞技术的方法检测了大约2600万个细胞,然后通过相应的统计分析方法进行分析。结果发现,在传统分型一致的情况下,由于遗传或者非遗传的因素,肿瘤细胞和免疫细胞等组成的肿瘤微生态系统在不同个体肿瘤组织中间有很明显的差别,反映了肿瘤微生态系统内部的一种复杂的状态。
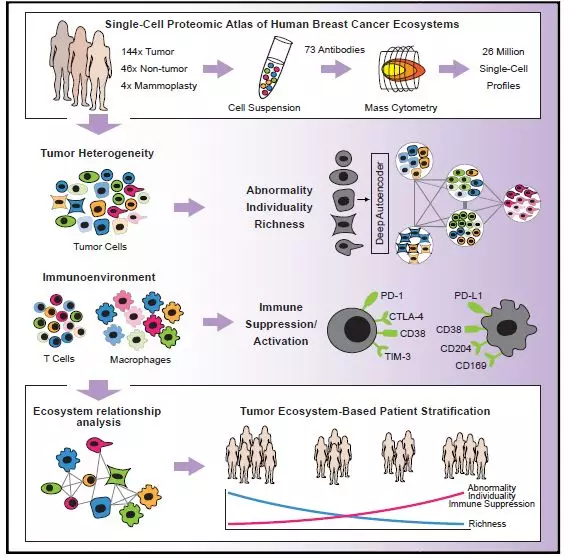
图1 全文图解摘要
通过上述方法,对这些组织标本中的肿瘤细胞和免疫细胞进行表型分析后结果表明,肿瘤组织中存在着大量的T淋巴细胞和骨髓来源的细胞。深度挖掘数据,使用t-SNE 以及PhenoGraph的方法对这些T细胞表型进行分析,基于CD4和CD8a分子,和FOXP3,CCR7等15个表面marker,分别将CD4 T细胞细和CD8 T细胞各分为10个类型,随后比较了肿瘤组织和正常组织中这些类型的T细胞所占的比例。同时作者对肿瘤浸润性巨噬细胞(TAM)也基于不同的表面标志物进行了分类,分为5大类,这5大类TAM中包含表型差异的19小类TAM,同样也比较了这些不同类型的TAM在肿瘤组织和正常组织之间的差异。在T细胞和TAM细胞中作者重点分析了诱导T细胞耗竭的相关因子如PD-1,CTLA-4,CD38和TIM-3等分子,以及这些分子的配体在不同组织中T细胞和TAM之间表达的差异,并且对上述抑制性分子与肿瘤预后进行了相关分析。作者发现PD-L1+的TAMs和耗竭的无功能的T细胞在ER受体阳性亦或是ER阴性的高危患者标本中数量较多,表明了这些抑制性分子与肿瘤的不良预后密切相关。
随后作者通过对不同来源的乳腺癌标本以及对照标本中的上皮细胞来源的肿瘤细胞进行分型,同样使用t-SNE 以及PhenoGraph的分析方法,作者根据30种不同的表面标志物所构成的不同组合形式,将乳腺癌上皮细胞分为45群,分别表示为Ep01–Ep45,随后将这45群细胞归纳为7种Luminal类型,表示为L1-L7,以及2种基础类型B1和B2。在分群后,使用L1-L7以及B1,B2分型与临床中目前普遍采用的Luminal分型进行对比分析,将所有数据进行深度挖掘。通过上述的肿瘤细胞分型,作者发现肿瘤组织的上皮细胞表型比正常组织有明显多样化的特点。但是即便如此,在每个患者的肿瘤中依然有占有绝对数量优势的某一种肿瘤细胞类型存在。而这种优势类型肿瘤细胞的差异就是肿瘤治疗差异性不良预后以及耐药产生的重要原因。
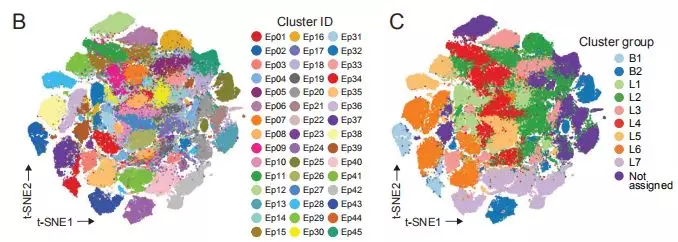
图2:Ep01-Ep45;L1-L7,B1,B2
作者还发现, ERa+的细胞在ER+型的肿瘤患者中数量差别明显,在Luminal B型肿瘤中ERa+肿瘤细胞的数量与PD-L1阳性的TAM以及耗竭T细胞的数量具有显著的相关性。表明肿瘤细胞的表型与肿瘤浸润性免疫细胞的表型存在相互影响相互干扰的情况,它们相互作用,形成了各自特有的肿瘤微生态系统。
综上所述,作者采用单细胞蛋白组学,通过质谱流式细胞技术结合大数据统计分析的方法对乳腺癌肿瘤组织进行分析,描绘出了乳腺癌组织的肿瘤微生态系统。作者提出乳腺癌的分型不能仅仅局限于肿瘤细胞的表型,同时应该将肿瘤浸润性免疫细胞的表型考虑在内,因为在肿瘤微生态系统中,肿瘤细胞和免疫细胞是互相影响,协同促进的。这一理念将为今后乳腺癌的精准治疗提供了依据和方法。