高效的人群检测,对主动监控诸如SARS-CoV-2 这样的病原体的传播是非常重要的,在降低传播方面提供了定量数据来支持决策者。在疫情开始的时候,COVID-19 几乎毫无例外地使用逆转录聚合酶链式扩增反应(RT-PCR)方法来检测,但是单纯依赖一种技术是有明显劣势的。这种在世界范围对RT-PCR 方法前所未有的需求,导致检测和其他必要试剂的长期短缺,限制了检测容量。
与基于PCR 的检测相比,质谱检测显著更加具有特异性,要求一个更宽的视角去处理不同的样本基质和仪器技术。因此,根特大学(Ghent University)的研究人员发起了一项基于Cov-MS联盟协作方案,该联盟已经产生了一个通用的、广泛适用的基于质谱的分析方案,可以轻松地适应广泛可变的测试设施环境。
研究者随后成立了一个协作联盟(MS-Cov),由15 个学术科研和工业实验室组成,SCIEX等业界主要质谱供应商也在列。研究者利用SCIEX TripleTOF™ 6600+ 系统上采用SWATH® 采集方法获得的高分辨率质谱仪器数据,创建了一个独立于质谱仪器供应商的Skyline文档,其中17个肽段生物标志物来自公开数据中检测到的两个SARS-CoV-2结构蛋白,即重组核衣壳蛋白(NCAP_SARS2)和刺突蛋白(SPIKE_SARS2)。向该联盟的所有成员提供了Skyline文件,以及包含重组NCAP和SPIKE蛋白的样品试剂盒,以及阴性患者背景下的稀释系列。15个实验室共享来自4个不同仪器供应商的数据,这些数据被集中收集,并用于供应商独立的免费软件(Skyline),以评估候选特征肽的最 终整体方案性能和适用性,我们建立了Cov-MS数字孵化器,开放的交流和数据共享将有助于将该分析方案转化为全 球不同的临床环境。所有补充数据均可在Cov-MS数字孵化器中获得。
Cov-MS联盟,提高MRM
检测的灵敏度和稳定性
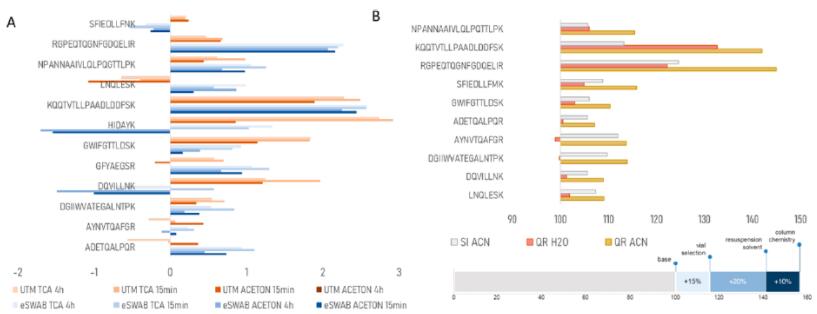

图3. Cov-MS联盟报告(红色,图片引用自pubs.acs.org/jacsau) 。(A) 优化样品制备。比较不同的样本保存培养基、三氯 乙 酸(TCA)沉淀和15分钟的消化酶解(n = 5)。LogSumAUC的增加表示为对数转换。主要集中在三个优化方面:应用不同的酸沉淀策略,即用三氯 乙 酸(TCA)和盐酸(HCl),将消化酶解时间缩短到15分钟,以及使用不同的保存培养基。虽然这些改变可以提高整体的信号(图3),但最 好的策略还是通过相关多肽的MRM方法优化和消除离子抑 制或通过降低基质干扰以及实验条件更好。现在可以实现一个少于30分钟的完整样品制备工作流程。
(B)不同样品制备耗材的比较。在标准的工作流程中,肽段在水中溶解并转移到弹簧内衬管(SI)样品瓶。使用全回收(QR)小瓶,并在溶剂中加入5%的乙腈(ACN),可以提高溶剂中大部分肽段的信号,但在UTM中没有信号提升。底部的栏显示估计的整体增益归因于消耗品。
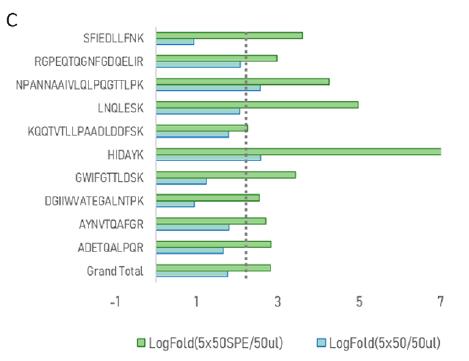
图3. Cov-MS联盟报告(红色,图片引用自pubs.acs.org/jacsau) 。 (C)增加eSwab样品的样本载样量。由于eSwabs使用生理盐水作为保存液,增加柱上样品的量可能是有益的。因此,我们评估了将载样量增加5倍的影响,无论是否使用SPE。整体平均LogSumAUC增加2.3倍(虚线),比如,信号增加了5倍,如果将样本分成5份,采用SPE策略 。也就是说,如果将5次50 μL的消化液浓缩到一个SPE柱上,至少可以相当于两个Ct值。自动化处理将使这一发现得到巩固和扩展,但是我们在这里提醒可能会有SPE过载现象。由于缺乏内部自动化处理方案,我们继续采用原来的操作过程,50 μL样品量和10 μL柱上进样时,不应采用SPE前处理。
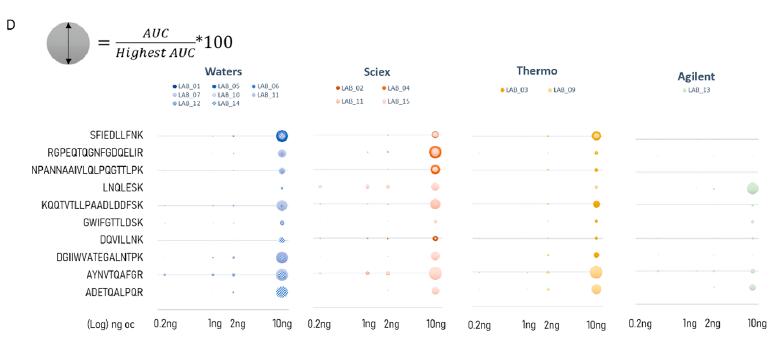
图3. Cov-MS联盟报告(红色,图片引用自pubs.acs.org/jacsau) 。(D) Cov-MS联盟内的数据采集。为了简化所有这些并行实验方案,研究者为联盟成员提供了详细的方法优化标准操作程序(SOP)、包含17个肽段(145 个MRM)的Skyline模板和Cov-MS试剂盒。这些试剂盒含有重组核衣壳蛋白NCAP和刺突蛋白SPIKE的消化液,以及来自健康供体的UTM背景的稀释液体,一式三份。重要的是,研究表明只有新一代串联四极杆质谱仪器,能够达到足够的灵敏度。此外,汇编数据结果证实了最初的假设,所选肽段是具有实验特异性的。这些初步结果表明,不同的供应商可以从不同的目标肽段中通过叠加提高灵敏度,即使是相同的MRM。一个突出的例子是RGEPQTQGNFGDQELIR肽,它在SCIEX仪器上特别有效,可能是因为相应的离子源更适合于多电荷的多肽。
COVID-19质谱检测,用于评估
潜在检测性能的大型患者队列
研究者详细描述了Cov-MS联盟为建立一个稳定、灵敏的正交试验来诊确认SARS-CoV-2阳性所做的努力。为了能够跟踪每天进行的数百万次RT-PCR检测并与之保持一致,科学界的集体努力至关重要,这不仅仅是因为MRM检测以前很少被用于检测病毒。
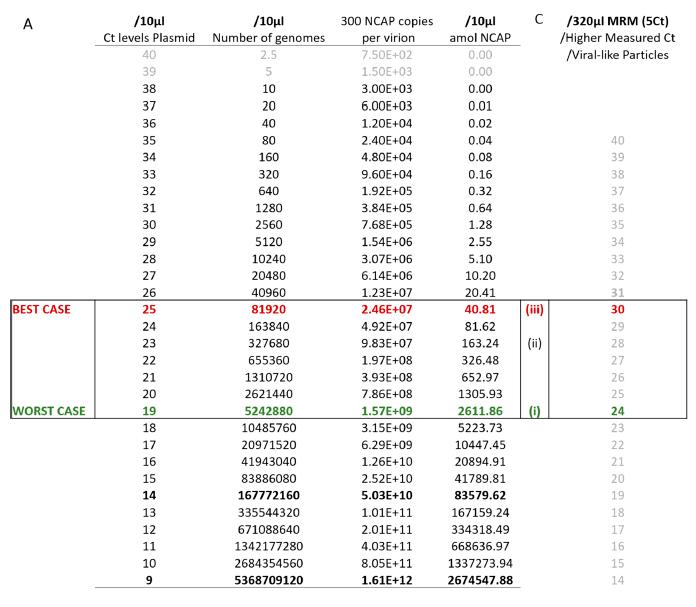
图5. MRM能力的预测。(A)理论上将Ct与MRM测定方法相关联的绝 对量。在完 美 的条件下(即质粒),用内部RT-PCR检测10 μL样品中的10个基因组,Ct值为38;在Ct值为40时,检测2.5个基因组。假设每个病毒粒子携带300-350个核衣壳蛋白(NCAP)分子,可以很容易地计算出10 μL中NCAP分子的绝 对数量。表中突出显示的部分 (C) Ct和MRM检测之间潜在的实际相关性。通过增加32倍的上样量,富集目标可以产生5倍 Ct值的灵敏度。临床RT-PCR预期比质粒更高,MRM信号可能因为病毒样颗粒(VLPs)而更高,这一事实映证这一点。
在大规模人群检测应用场景,
提高检测通量
基于液质工作流程的一个主要缺点是,数据采集不能在单个仪器上并行进行,而RT-PCR检测使用多孔板。然而,使用8分钟的梯度,一种仪器可以每天测量超过150名患者,通过多通道液相方案,这可以增加到每天500名患者。Cov-MS联盟的一名成员(Alderley analytics)还研究了2分钟梯度的应用,并表明当基质相对干净时,才可行,在没有并行方案的情况下,每台仪器每天可增加样本检测通量至600名患者。如我们的初步结果所示,在稳定同位素标记和抗肽段抗体俘获 (SISCAPA)等预先免疫富集的情况下,可以达到低至1分钟的梯度。至少从样品制备的角度来看,没有理由不能使用机器人自动化操作,就像RT-PCR制备一样。
最近有一项突破性的技术,可以进一步提高产量,那就是声波激发质谱(AEMS)。SCIEX Echo™ MS系统,纳升液滴以每秒三个样本的速率从样品中喷射到仪器中,每个液滴可测量4个MRM离子对。这可能会预期每台仪器每天采样约30000名患者。
下一期,COVID-19 检测3」,我们将介绍SCIEX 使用声波激发质谱开发的肽段定量方法的研究进展。
如果,希望了解更多关于COVID-19质谱检测方法,SCIEX SWATH® 采集策略,SCIEX Echo™ MS系统,可以扫码留下您的问题,我们的产品专家会与您沟通。

参考文献与信息
1. Cov-MS: A Community-based Template Assay for Mass-Spectrometry-based Protein Detection in SARS-CoV-2 Patients, JACS Au Article ASAP (2021); DOI: 10.1021/jacsau.1c00048;
2. 获取有关比利时根特大学的药物生物技术实验室的更多信息,请访问https://www.ugent.be/fw/pharmaceutics/pharmbiotech/en
3. 您可以在MedRXiv 上了解更多关于这个检测的更多信息,希望获得 Cov-MS 数据孵化器,请发送申请邮件至 covms@ugent.be
4. 获取有关SCIEX TripleTOF™ 系统基于SWATH® 采集策略的更多信息, 请访问https://sciex.com.cn/technology/swath-acquisition
5. 获取有关SCIEX Echo™ MS系统的更多信息,请访问https://sciex.com.cn/products/integrated-solutions/Echo-ms
声明:版权为 SCIEX 所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权, 转载时须注明「来源:SCIEX」。申请授权转载请在该文章下“写留言"。