文章来源于公众号“RWD生命科学研究院”
文章概述
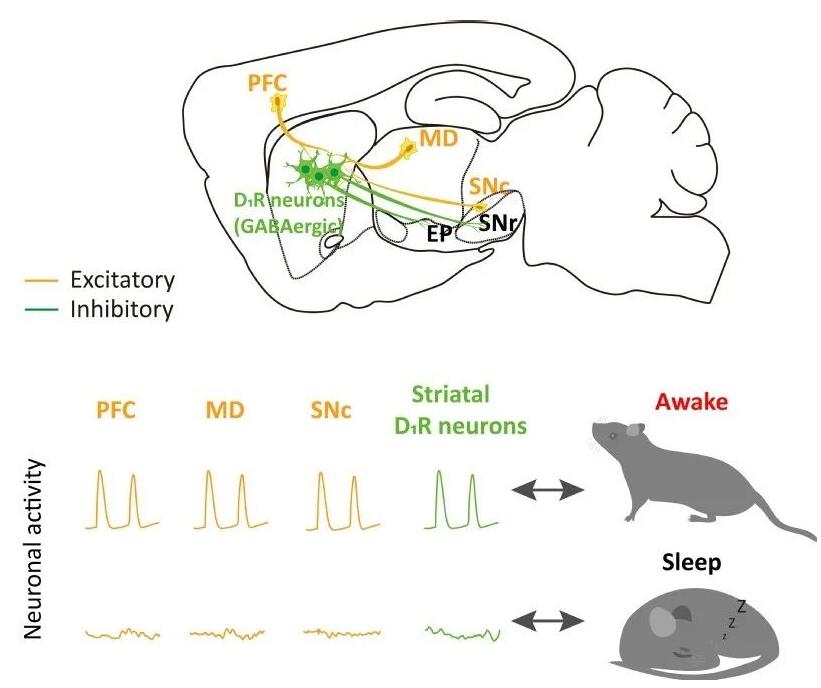
帕金森病(Parkinson’s disease, PD)患者伴随有严重的睡眠障碍,包括嗜睡、失眠、快速眼动(Rapid Eye Movement, REM)睡眠行为障碍,有超过50%的PD患者受到嗜睡的影响,但是其机制目前并不明确。2022年1月11日,复旦大学脑科学研究院黄志力和曲卫敏教授团队在《Current Biology》上发表题“Striatal neurons expressing dopamine D1 receptor promote wakefulness in mice”的文章,该研究证实了背侧纹状体多巴胺能神经元(Dopamine D1 Receptor, D1R)在睡眠行为中的作用,揭示了其调控觉醒的神经环路机制,为帕金森病伴发睡眠障碍的治 疗提供新策略。

核心观点
1、纹状体 D1R 神经元在觉醒期高度活跃,在非快速眼动(Non-Rapid Eye Movement, NREM)睡眠期安静;
2、纹状体D1R神经元的活动与前额叶皮层(Prefrontal Cortex, PFC)和背内侧丘脑(Mediodorsal Thalamus, MD)神经元高度同步;
3、纹状体D1R神经元通过下游的苍白球内侧部 (Entopeduncular Nucleus, EP)和黑质网状部(Substantia Nigra pars reticulata, SNr)神经元控制觉醒。
研究结果分析
1.激活纹状体D1R神经元能够诱导小鼠从NREM睡眠到清醒状态的瞬时转变
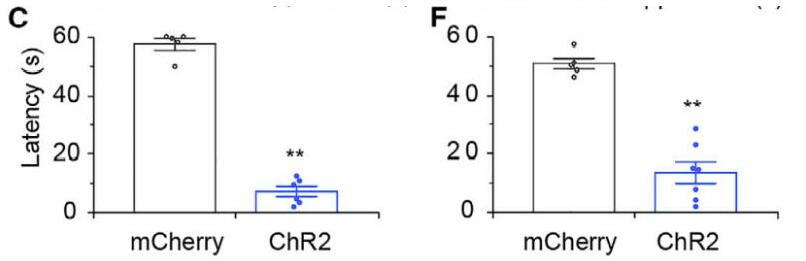
为了研究纹状体D1R神经元对睡眠状态的控制作用,研究者用到了D1-ChR2-YFP小鼠,用于进行光遗传刺激,同时结合在体脑电肌电记录睡眠-觉醒状态。在小鼠NREM睡眠期间,光遗传激活D1R神经元的可诱导小鼠立即从NREM睡眠过渡到清醒状态(皮质Delta波活动和肌肉张力的出现快速变化)。光刺激纹状体D1R神经元降低脑电Delta波功率,增加肌电均方根值(Root Mean Square, RMS)。在激发后60 s内,从NREM睡眠到觉醒的概率迅速增加;从NREM睡眠到觉醒的潜伏期呈现刺激频率依赖性的缩短。D1-ChR2-YFP小鼠在1、5、10、20或30 Hz持续10 s的光刺激下,从NREM睡眠到觉醒的潜伏期分别比对照组小鼠缩短20.3%、37.7%、64.2%、79.4%和84.9%。值得注意的是,大脑状态的反应对NREM睡眠具有选择性,在REM睡眠中激活纹状体D1R神经元对大脑状态没有影响。综上所述,激活纹状体D1R神经元可诱导小鼠从NREM睡眠立即过渡到清醒状态。
2.纹状体D1R神经元在自发清醒和对外界刺激反应时活跃
为了评估自由移动小鼠在自发睡眠-觉醒状态下纹状体D1R神经元的群体活动,研究者利用光纤记录系统记录了纹状体D1R神经元的钙信号,利用脑电肌电记录系统分析小鼠的睡眠-觉醒状态。纹状体D1R神经元钙信号在小鼠清醒时比REM或NREM时更强。值得注意的是,纹状体D1R神经元在NREM到觉醒过渡之前活动开始增加,而在觉醒到NREM过渡之前活动减少。相比之下,纹状体D1R神经元在从NREM睡眠到REM睡眠或从REM睡眠到觉醒期间的钙活动没有显著差异。这些研究结果表明,纹状体D1R神经元在从NREM睡眠到清醒的过渡期间活动增加,并且在自发清醒时最活跃。
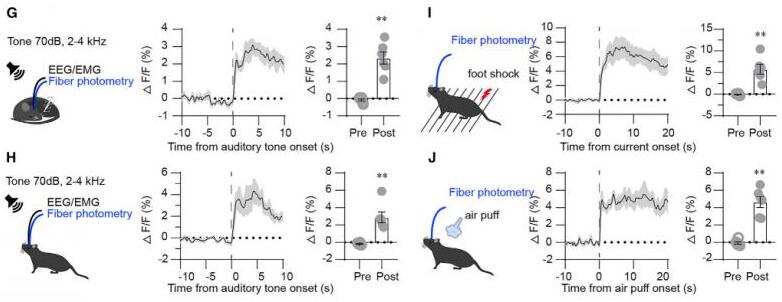
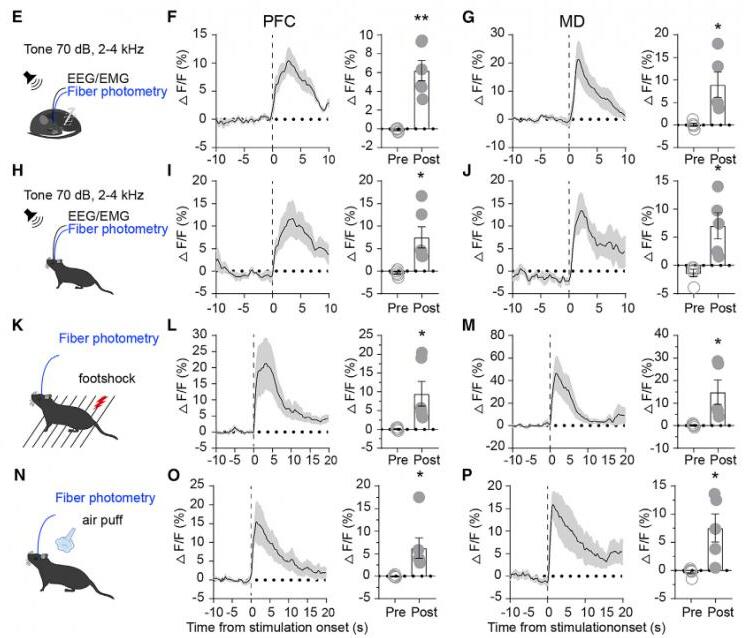
为了研究纹状体D1R神经元对外界刺激的反应动态,研究者记录了不同显著性刺激下小鼠纹状体D1R神经元的钙信号。在NREM睡眠或清醒状态时,给予70 db、24 khz、持续5 s的声音刺激。在NREM睡眠期间,给予声音刺激,纹状体D1R神经元的活动立即增加,小鼠立即从NREM睡眠转到清醒。在清醒时,给予声音刺激会进一步增加纹状体D1R神经元的活动。其它刺激,比如足底电击、吹气等也会导致纹状体D1R神经元活性增加。这些结果表明,纹状体D1R神经元不仅在自发清醒时被激活,而且在唤醒刺激时也会被激活。
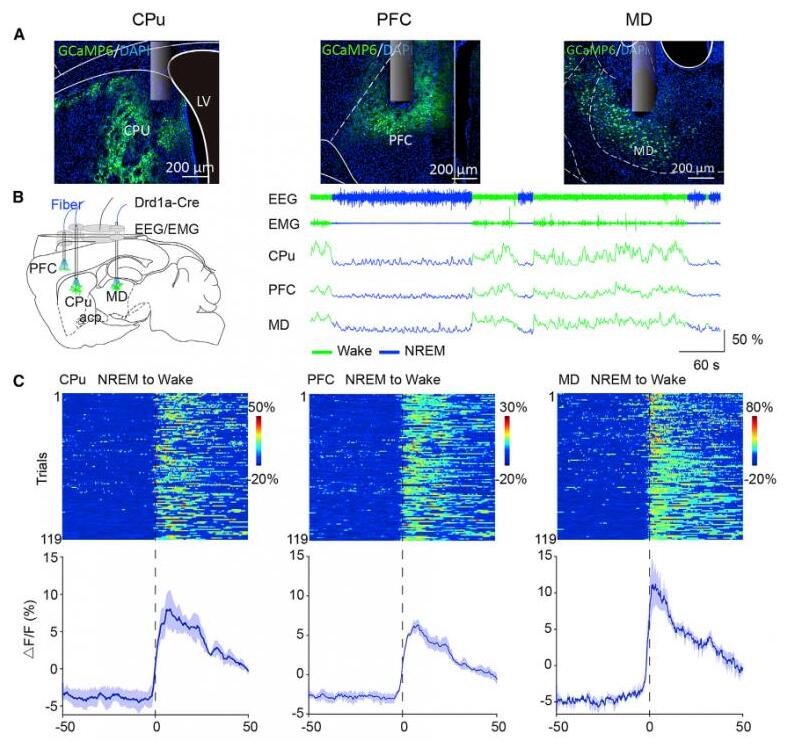
3.纹状体D1R神经元与PFC和MD神经元在自发睡眠-觉醒周期中的活动高度同步,并受到它们的调节
背侧纹状体接受来自黑质下致密部(Substantia Nigra pars compacta, SNc)的多巴胺能神经传入,以及大脑皮层和丘脑的谷氨酸能神经传入,但是GABA能的神经传入很少被记录。研究者随后探讨了对背侧纹状体有神经投射的区域是否也与参与了睡眠-觉醒的转换。利用光纤记录系统,研究者记录了小鼠SNc、PFC、和MD在大脑不同状态时的钙活动。与纹状体D1R神经元活动相似,PFC和MD神经元在清醒时比NREM睡眠时表现出更高的钙信号。PFC/MD中谷氨酸能神经元和SNc中多巴胺能神经元在NREM睡眠到觉醒过渡后活动增加,在觉醒到NREM睡眠过渡后活动降低。
为了明确地靶向支配背侧纹状体的神经元,研究者采用病毒逆行示踪方法来标记这些对背侧纹状体发出投射的神经元。这些投射到纹状体的皮层和丘脑神经元在NREM睡眠到觉醒过渡期间活动增加,而在觉醒到NREM睡眠的过渡期间活动则减少。并且这些特异性的PFC-纹状体或MD-纹状体投射神经元的活动比PFC或MD神经元活动下降的更快。PFC和MD神经元存在许多细胞类型,并支配许多下游核团。这些活动下降率的差异可能归因投射到纹状体的神经元只是PFC和MD神经元的一个亚型。此外,在睡眠或清醒时给予听觉刺激、足底电击或者吹气刺激,PFC和MD神经元的活动也会增强。这些结果表明,纹状体D1R神经元的活动受到来自PFC和MD兴奋性传入的影响。
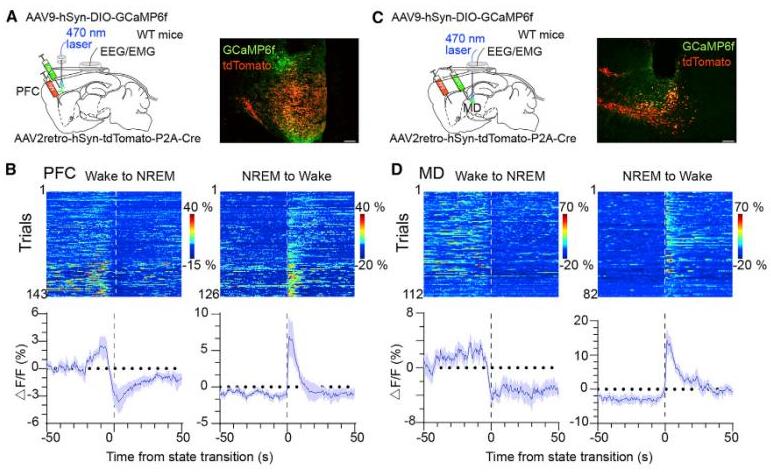
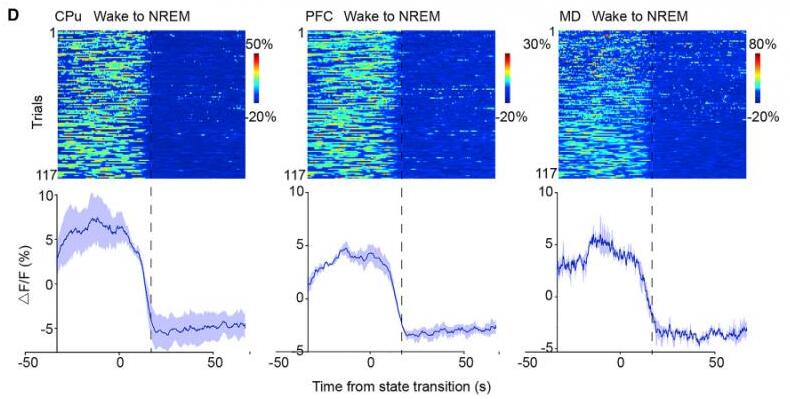
为了进一步澄清它们之间的联系,研究者采用多通道光纤记录法同时记录PFC、MD和纹状体D1R神经元的群体钙活动。结果显示纹状体D1R神经元、PFC神经元和MD神经元的活动在清醒时同时增加,在NREM睡眠时同时减少。Pearson相关性分析表明,这些脑区神经活动高度同步。PFC-纹状体投射神经元、MD-纹状体投射神经元和纹状体D1R神经元在NREM睡眠到觉醒过渡期间活动增加,并在觉醒到NREM睡眠过渡期间活动降低。
此外,为了进一步确定纹状体D1R神经元的活动是否与其上游同步,研究者采用了双色多通道光纤记录,同时将不同激发波长的钙荧光探针分别注射到纹状体或者PFC/MD。与单色多通道光纤记录结果一致,纹状体D1R神经元的钙信号和PFC神经元和MD神经元的钙信号在清醒时均增加,在NREM睡眠时均降低。相关性分析表明,这些脑区间的神经活动高度同步。为了研究PFC和MD神经元抑 制后对大脑状态和纹状体D1R神经元活动的影响,研究者采用了化学遗传学抑 制PFC或MD的神经元的活动,并利用光纤记录系统记录纹状体D1R神经元的活动。结果显示,抑 制PFC神经元的活性导致觉醒减少以及NREM睡眠增加,同时,纹状体D1R神经元钙信号的峰值和频率降低;抑 制MD神经元活性清醒时间显著降低,纹状体D1R神经元钙信号的峰值和频率也显著降低。这些研究结果表明,纹状体D1R神经元、PFC神经元和MD神经元的钙离子活动与睡眠和觉醒过程中的波动高度同步,且纹状体D1R神经活动受PFC和MD神经传入的调节。
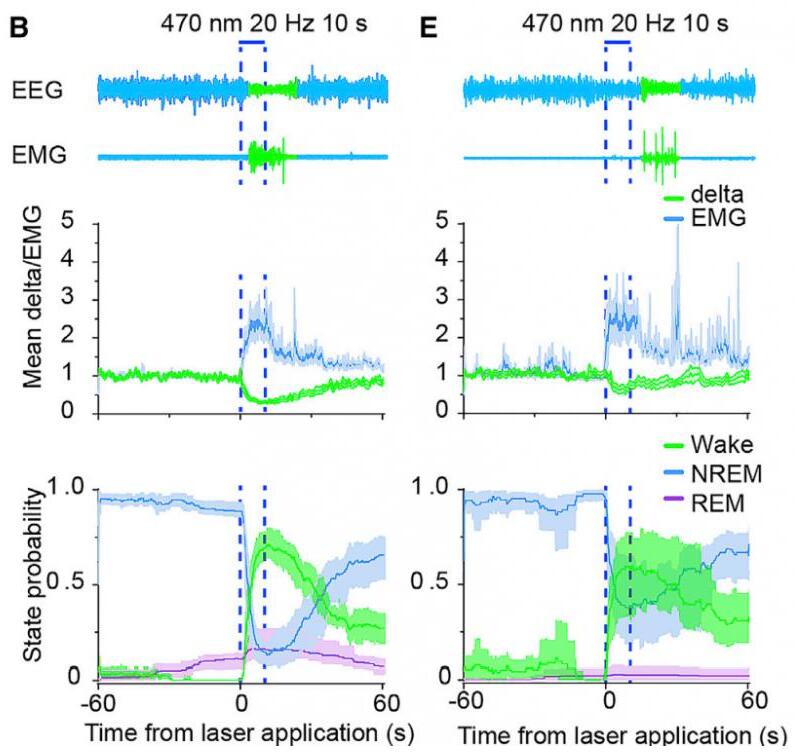
4.激活皮质-纹状体、丘脑-纹状体和黑质-纹状体的神经投射均能诱发觉醒
为了研究PFC、MD和SNc对的背侧纹状体神经传入各自在清醒转变中的贡献。研究者利用光遗传技术分别激活PFC、MD和SNc神经元在背侧纹状体的末梢。对末梢进行激活均降低了脑电波Delta功率,并增加了肌电强度和清醒的概率。激活背侧纹状体中PFC或MD神经元末梢导致小鼠从NREM睡眠到觉醒的过渡潜伏期缩短,且呈刺激频率依赖性。在1、5、10、20和30 Hz的光刺激下,激活纹状体中PFC神经元末梢小鼠从NREM睡眠到觉醒的潜伏期分别缩短了32%、55%、88%、90%和98%。在1、5、10、20和30 Hz的光刺激下,激活纹状体中MD神经元末梢小鼠从NREM睡眠到觉醒的潜伏期分别缩短了16.8%、33.3%、78.7%、80.4%和66.7%。激活纹状体中SNc神经元末梢小鼠从NREM睡眠到觉醒转变的潜伏期减少,但是没有刺激频率依赖性。接下来,研究者分析了每个投射的唤醒促进效果。皮质-纹状体投射的唤醒促进作用最 强,黑质-纹状体投射的唤醒促进作用最弱。总之,激活皮质-纹状体、丘脑-纹状体或黑质-纹状体的投射足以引起觉醒。
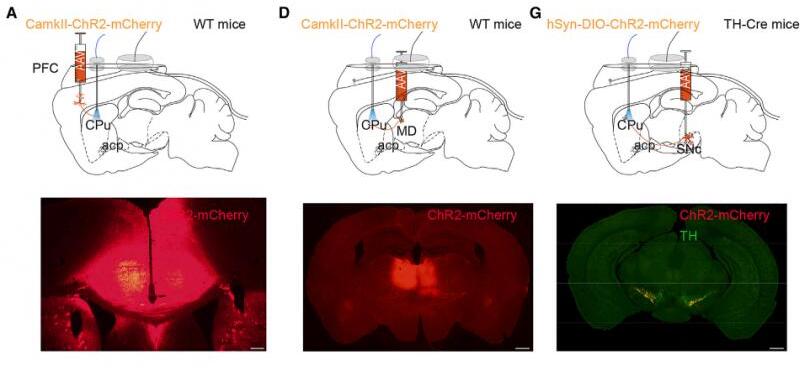
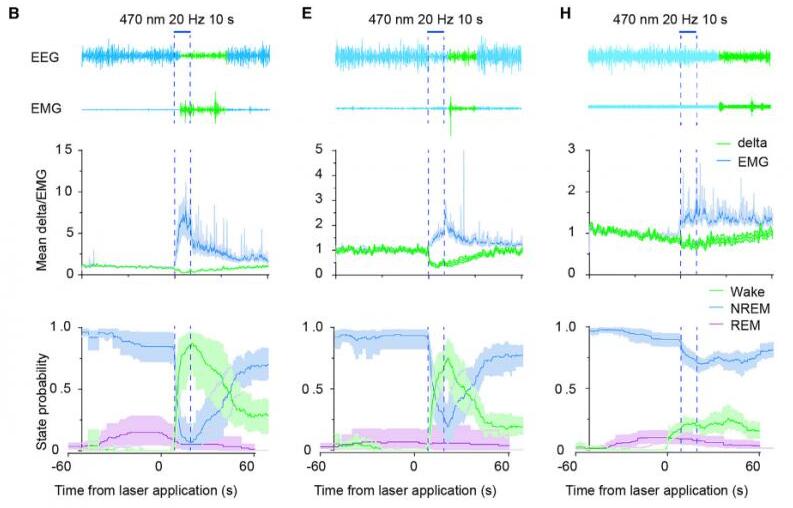

5.纹状体D1R神经元通过下游的EP和SNr区域控制觉醒
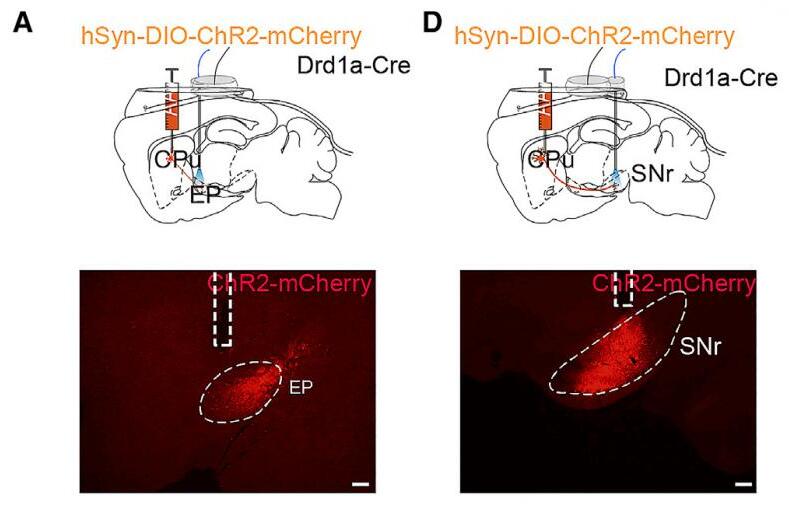
为了阐明纹状体D1R神经元下游脑区在调控觉醒的作用,研究者在纹状体中条件性表达了光通道蛋白ChR2,并在纹状体的下游区域E P或SNr分别埋入光纤。在NREM睡眠期间,激活EP或SNr中纹状体末梢导致脑电波Delta功率降低,肌电张力增加。激活纹状体-EP投射或纹状体-SNr投射均会增加了觉醒的概率,并降低了NREM睡眠到觉醒的潜伏期。这些结果表明,光遗传激活源自纹状体D1R神经元的纹状体-EP投射或纹状体-SNr投射均能引起觉醒的。

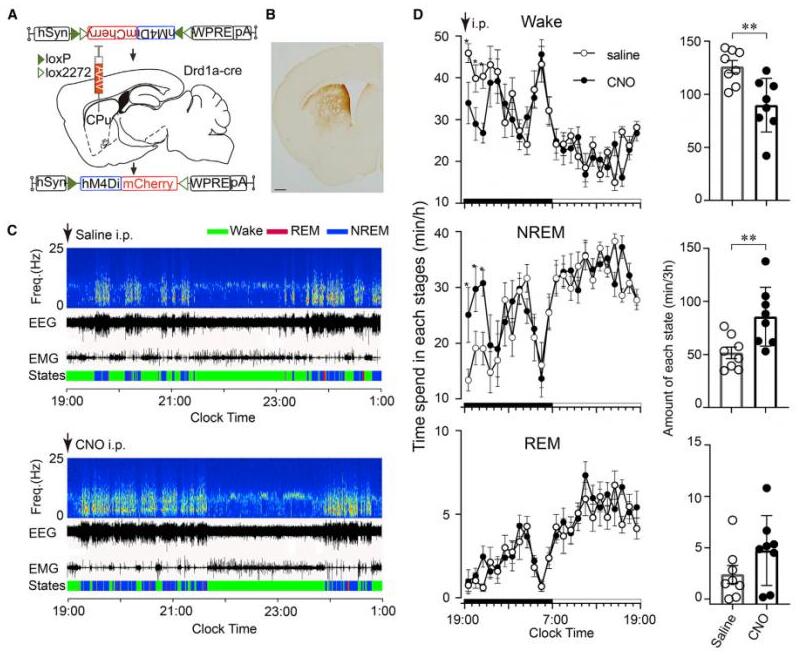
6.抑制纹状体D1R神经元可减少觉醒
最后,研究者利用化学遗传学的方法来抑 制纹状体D1R神经元活性,来检测它们对睡眠-觉醒状态的控制作用。在小鼠活动期抑 制纹状体D1R神经元活性,NREM睡眠在给药后3小时内显著增加(66.1%),清醒时间显著减少(28.9%)。这些结果表明,纹状体D1R神经元的抑 制增加了NREM睡眠,并减少了觉醒。
总结
本研究作者发现纹状体D1R神经元的激活可诱导NREM睡眠向清醒状态的瞬间转换,且纹状体D1R神经元在清醒状态下更加活跃。纹状体D1R神经元的活动与投射到纹状体的皮质或丘脑神经元的活动是同步的。激活皮质-纹状体、丘脑-纹状体、黑质-纹状体,或者纹状体-EP、纹状体-SNr的神经投射,会让动物立即从NREM睡眠向觉醒的状态转变。纹状体D1R神经元的上下游构成了一个控制觉醒的上下回路。该研究的结果揭示了一个通过纹状体D1R神经元调节觉醒的神经环路,为疾病相关的睡眠障碍治 疗提供了新策略。

亮点研究方法
这项工作利用了光遗传学、光纤记录以及在体脑电肌电记录等技术揭示了纹状体D1R神经元调节觉醒的神经环路。瑞沃德神经科学研究解决方案提供贯穿动物疾病模型构建、检测和评估、调控机制研究的全流程产品和服务,覆盖该研究中涉及的光遗传学、光纤记录、在体脑电肌电记录、免疫组化等所有研究工作。在该项研究工作中,瑞沃德提供了用于病毒注射和颅脑手术的脑立体定位系统,确保相关实验操作能够精确完成。截止目前,瑞沃德产品及服务覆盖海内外 100 多个国家和地区,客户涵盖全 球700+医院,1000+科研院所,6000+高等院校,已助力全 球科研人员发表SCI文章12000+,在行业内得到广泛认可。
