染色质形成同时对细胞内的一些生理过程,如DNA复制、转录、修复等产生了巨大的障碍。为此SWI/SNF家族染色质重塑复合物通过利用ATP水解的能量调控染色质的结构,广泛参与调控干细胞分化、重编程、免疫应答、学习和记忆、癌症等不同的生物学过程。染色质重塑复合物从酵母到人都保守,但其发挥功能的分子机理尚不了解,是长期存在的染色质生物学领域的基本问题。
清华大学生命科学学院陈柱成师从著名结构生物学家尼古拉-帕夫拉提奇,研究DNA损失修复以及DNA同源重组的分子机理。2016年报道了Snf2蛋白基态晶体结构,阐释了Snf2的自抑制机理。2017年其研究组在Nature上发文,成功获得了Snf2-nucleosome 分辨率为4.69 Å的电镜结构,揭示了核小体能够激发Snf2蛋白ATP酶活的机理。
在此基础上,陈柱成教授与李雪明教授,以及中科院物理所李明研究员合作,解析了不同核苷酸状态下Snf2-核小体复合物的冷冻电镜结构,揭示了Snf2介导的染色质重塑中DNA滑移的机理。
这一研究成果公布在3月13日的Nature杂志上。
这些最新研究在前研究基础上,利用冷冻电镜技术,进一步确定了不同核苷酸(ADP和ADP-BeFx)状态下。Snf2-核小体复合物的高分辨结构。
研究人员发现在一个ATPase循环过程中,Snf2存在打开-闭合的构象变化。在打开状态下,Snf2在核小体结合点(SHL2)引起1bp DNA的凸起,这个形变沿DNA链向入口端传递,使得1bp DNA被拉入核小体。而且DNA前导链比后随链有更明显的移动,显示DNA的“扭曲-滑移”运动。ADP-BeFx的结合导致酶构象闭合,核小体恢复到自然状态,没有明显的扭曲。Snf2介导的这种DNA运动模式超出一般想象。
之后为了验证这个过程,研究人员又利用单分子荧光技术(smFRET)确认了溶液状态的DNA运动与冷冻电镜结构一致。最后,研究者提出了染色质重塑的两步走”DNA波”模型:第一步,ATP水解,Snf2张开,把DNA从入口端拉进,并在SHL2处储存1bp DNA形变(“DNA波”);第二步,ATP结合,Snf2关闭,使得DNA形变向出口端传递,就像水波沿湖面传递一样,最终实现DNA对组蛋白的相对移动。
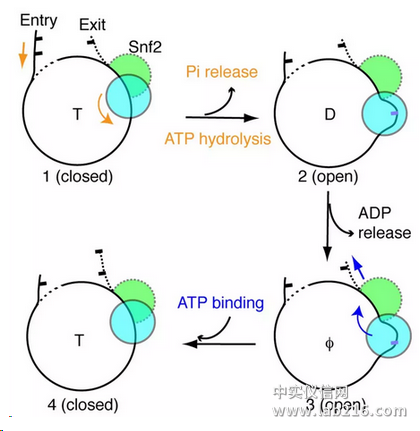
Snf2介导的核小体滑动模型
这个模型表明Snf2水解一个ATP,移动1bp DNA。同时也解释了DNA移动的方向性机制。这篇论文解答了染色质重塑过程中DNA移位的基本原理,将会在染色质领域产生非常广泛的影响。
原文标题:
Mechanism of DNA translocation underlying chromatin remodelling by Snf2
作者简介:
陈柱成 博士
教授,博导,青年千人
1998 南开大学 化学系 学士
2009 康奈尔大学(Cornell University) 生物化学与结构生物学 博士
2008-2011 西南医学中心(HHMI/UT Southwestern Medical Center) 博士后
2011 -清华大学教授
主要科研领域与方向
我们实验室有两个主要研究方向:染色质生物学(chromatin biology)和细胞分裂(Cell division)。 真核细胞的DNA缠绕组蛋白,形成核小体(nucleosome),并进一步组装成染色质 (chromatin),储存在细胞核中。染色质形成对基因组起保护作用。然而,染色质同时妨碍细胞在需要的时候读取这些遗传信息。真核细胞进化出一系列染色质调控因子,它们有的对核小体进行化学修饰 (如乙酰化),有的移动核小体的空间位置,有的交换组蛋白变体,有的甚至拆分核小体。我们实验室利用多种生物物理和生物化学手段研究这些染色质调控因子的结构、工作机理以及生物学功能。
真核细胞分裂时,微管(microtubule)细胞骨架体系发出信号,使细胞在正确的时间和正确的地点形成收缩环(contractile ring), 驱动细胞膜内陷,从而把染色体平均分配到两个子细胞中。我们实验室研究这条从微管到收缩环,调控细胞分裂面位置的关键信号通路的分子机理。