引 言
药物的合成与工艺的选择是药物研发的关键流程,合格的药物在初筛阶段,便需要一系列的表征。而在所有药物中,超过 80% 的药物活性组份 API(原料药)及其药物产品是以固态形式开发的,原料药需要与辅药结合才能获得最 终的药物制剂。
扫描电镜技术近年来已被广泛应用于材料,生物等科研及工业领域的研究,用于解析物质微观结构与性能的关系。扫描电镜采用电子束作为信号源,可以提供纳米级的分辨率,较为真实地反映药物制剂的微观结构,结合能谱技术,可以反应其成分信息。
01 原研和仿制药物逆向分析对比
原研包衣外侧为高密度滑石粉,而仿制包衣为有机物包裹少量滑石粉。
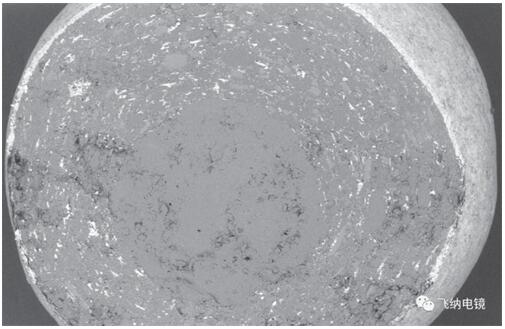
图|原研


图|仿制
结合能谱图,仿制 API 层出现较多的微孔结构,容易出现崩解、突释等情况。
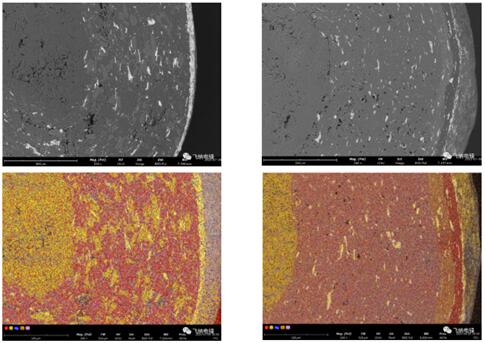
高倍观察,结合能谱分析,发现原研中的 Cl 的分布并不均匀,故 API 并非均匀分布,而原研中发现具有高 O 浓度的辅料晶粒。
结论
原研内 API 层是由 API 与一种辅料晶粒混合而成,而仿制药中 API 与辅料混合均匀分布。仿制与原研分别由截然不同的工艺制成,结构的不一致性可能会引起最 终药物释放的一致性。
02 片剂断面形貌及成分
包衣结构不光起到保护药物的作用,通过包衣配方、结构设计,可以改变药物释放的位置及速度,以实现胃溶、肠溶、缓释控释等不同功能。在改良、仿制、研发等环节,都可以使用扫描电镜对包衣的配方、结构进行分析。

图 |2 层包衣结构


图 |3 层包衣结构
可以通过飞纳电镜进行全景图像拼接,呈现包衣结构的微观全貌,还可以通过飞纳电镜能谱一体机对包衣的元素成分构成进行分析。

03 不同工艺下的微球形貌
根据药物性质,释放周期,人体内微球作用环境的不同需要选择不同的制备方法。常见的制备方法有:乳化-挥发法、喷雾干燥法、相分离法等。
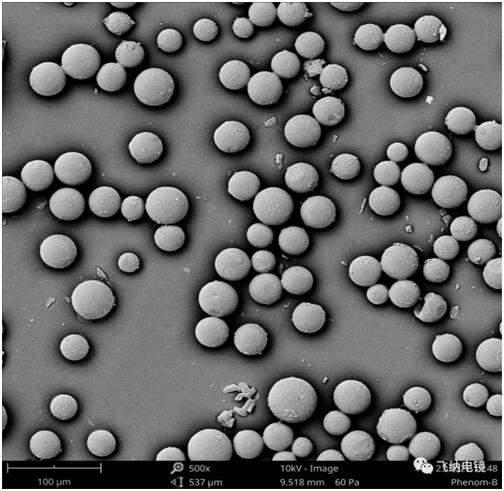
乳化法:醋酸奥曲肽


乳化法:醋酸奥曲肽 - 截面


乳化法:利培酮缓释微球


乳化法:利培酮缓释微球截面


相分离法:醋酸亮丙瑞林微球
04 微球表面和内部结构
微球表面的孔是控制微球释放的首要因素,表面孔洞会与内部孔洞通过孔隙或通道相通,如水分毫无阻力的进入内部会引起微孔骨架结构快速解体,造成突释。为了对微球表面进行修饰、包覆或结构设计,可通过扫描电镜对微球表面和“切开”后的内部结构进行表征分析。

图|包封前


图|包封后


图|优化前
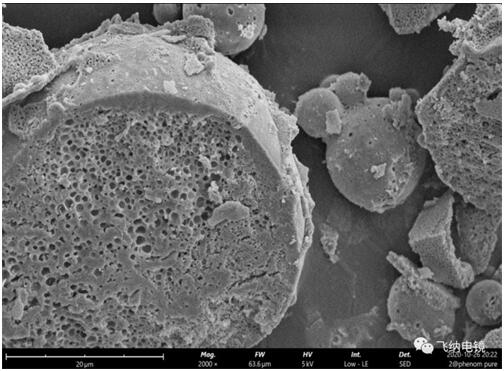

图|优化后
微球“切开”后进行断面表征,可见优化过后的微球,其表面孔径非常致密,大幅优化了前期的突释行为。
适用于制药行业的扫描电镜

飞纳台式扫描电镜
1、低加速电压
表面细节丰富,适合 API 辅料等电子束敏感样品分析
2、不喷金直接观察
适合观察医药相关等导电性较差的材料,简化制样步骤,提升表征效率
3、优秀的 BSD 探测器
BSD 成像是药物制剂结构表征的必不可少的工具,擅长包衣结构,API - 辅料的混合均匀性表征
4、对震动、磁场免疫
可灵活放置于产线、厂房等复杂环境
5、操作简单
通过自动化,降低操作难度,适用于不同经验级别的用户