各省、自治区、直辖市和新疆生产建设兵团药品监督管理局,各有关单位:
根据《国家药品监督管理局重点实验室管理办法》有关规定,为规范国家药品监督管理局重点实验室考核评估工作,国家药品监督管理局组织制定了《国家药品监督管理局重点实验室考核评估规则(试行)》。现予印发,请遵照执行。
国家药品监督管理局综合司
2022年1月4日
国家药品监督管理局重点实验室考核评估规则
(试行)
第一章 总 则
第一条 为加强国家药品监督管理局重点实验室(以下简称重点实验室)管理,规范重点实验室考核评估工作,根据《国家药品监督管理局重点实验室管理办法》(国药监科外〔2019〕56号),制定本规则。
第二条 考核评估的目的在于全面了解和检查重点实验室的运行和管理状况,总结经验和成效,发现问题和短板,促进重点实验室改进和提高,提升服务监管水平和能力。
第三条 考核评估工作坚持“公开、公平、公正”的原则,采取“定期评估、动态调整”的管理机制,尊重科学,注重实效。
第四条 考核评估工作包括考核和评估。考核每年开展一次,评估每5年开展一次。所有通过国家药品监督管理局评审认定的重点实验室均应当参加考核和评估。
第五条 考核评估的内容包括但不限于重点实验室的支撑条件建设情况、科学研究及服务监管情况、成果转移转化情况、开放交流与合作研究情况等。
第二章 职 责
第六条 国家药品监督管理局重点实验室建设管理办公室(以下简称管理办公室)负责制定考核评估规则和指标体系,组织开展考核评估工作,公布评估结果。
第七条 省级药品监督管理部门负责协助管理办公室开展考核评估工作,指导本行政区域内重点实验室依托单位做好考核评估准备工作,审核考核评估材料的完整性,结合考核结果督促整改落实。
第八条 重点实验室依托单位负责组织重点实验室准备考核评估材料,并对考核评估材料完整性和内容真实性负责,配合做好接受考核评估的相关工作,为重点实验室考核评估提供支持和保障。
第三章 考 核
第九条 考核包括重点实验室自评、省级药品监督管理部门年度考核以及国家药品监督管理局开展的考核工作。管理办公室制定国家药品监督管理局开展的考核实施方案,并组织实施。
第十条 重点实验室自评应针对建设进展、研究进展、成果转移转化、交流合作研究进展、存在问题及建议、下一步工作计划等开展,并提交《国家药品监督管理局重点实验室年度报告》。
省级药品监督管理部门应针对建设计划及目标年度完成情况、科研条件、实验室制度建设、人才培养、研究进展、成果转移转化、交流合作研究进展以及本年度监管科学研究成果组织考核,并提交《国家药品监督管理局重点实验室年度考核报告》。
国家药品监督管理局考核的主要内容包括但不限于省级药品监督管理部门提交的年度考核报告以及服务监管情况、督导检查、信息报送、整改落实等有关情况。如有必要,可组织专家进行现场考核。
第十一条 省级药品监督管理部门年度考核报告结果分为完成、基本完成、未完成。国家药品监督管理局考核结果分为通过、整改。
第十二条 国家药品监督管理局考核结果为“整改”的重点实验室,在1个月内将整改方案报省级药品监督管理部门,省级药品监督管理部门负责督促整改落实,并将落实情况报管理办公室。
第四章 评 估
第十三条 管理办公室制定评估计划和实施方案,组织开展评估。
第十四条 重点实验室依托单位在评估通知下达后2个月内,向所在地省级药品监督管理部门提交《国家药品监督管理局重点实验室评估申请书》,省级药品监督管理部门在申请书提交截止期满2周内统一报管理办公室。
第十五条 评估采取现场评估和会议评估相结合的方式进行。
第十六条 管理办公室组织专家进行现场评估。现场评估专家从评审专家库中随机抽取,每组由3-5人组成。
第十七条 现场评估主要核查评估材料与实际情况的符合性,了解重点实验室的运行状态等,并形成现场评估报告。
第十八条 现场评估结束后,管理办公室组织专家开展会议评估,评估专家组由相关领域专家组成。会议评估专家组根据《国家药品监督管理局重点实验室评估申请书》、汇报情况、现场评估、考核结果等情况独立打分,形成专家个人评估意见。
第十九条 会议评估结束后,管理办公室组织召开由国家药品监督管理局相关司局、直属单位等有关方面人员参加的评估结果评定会议。管理办公室根据会议意见形成评估结果。结果分为优秀、良好、合格、不合格。
第五章 评估结果应用
第二十条 评估结果为优秀的重点实验室予以通报表扬,并优先推荐申报国家重点实验室和国家科技奖励评审,优先推荐国家相关科技项目,优先参与国家药品监督管理局监管科学研究任务等。
第二十一条 重点实验室存在以下情况的,取消重点实验室资格:
(一)评估结果为不合格的;
(二)拒不参加考核评估的;
(三)考核未按时提交整改方案或者整改落实不到位的;
(四)在管理和运行中存在严重违法违纪的;
(五)存在弄虚作假、剽窃成果及其他违背科研诚信行为的;
(六)发生重大安全和管理事故的;
(七)违反政治意识形态要求、科技伦理、医学伦理等情况的。
第二十二条 重点实验室评估结果,由国家药品监督管理局向社会公告。管理办公室根据评估结果对重点实验室进行动态调整。
第六章 附 则
第二十三条 本规则自发布之日起施行。
第二十四条 本规则由管理办公室负责解释。
附:1.国家药品监督管理局重点实验室年度考核报告
附:2.国家药品监督管理局重点实验室考核专家组意见书
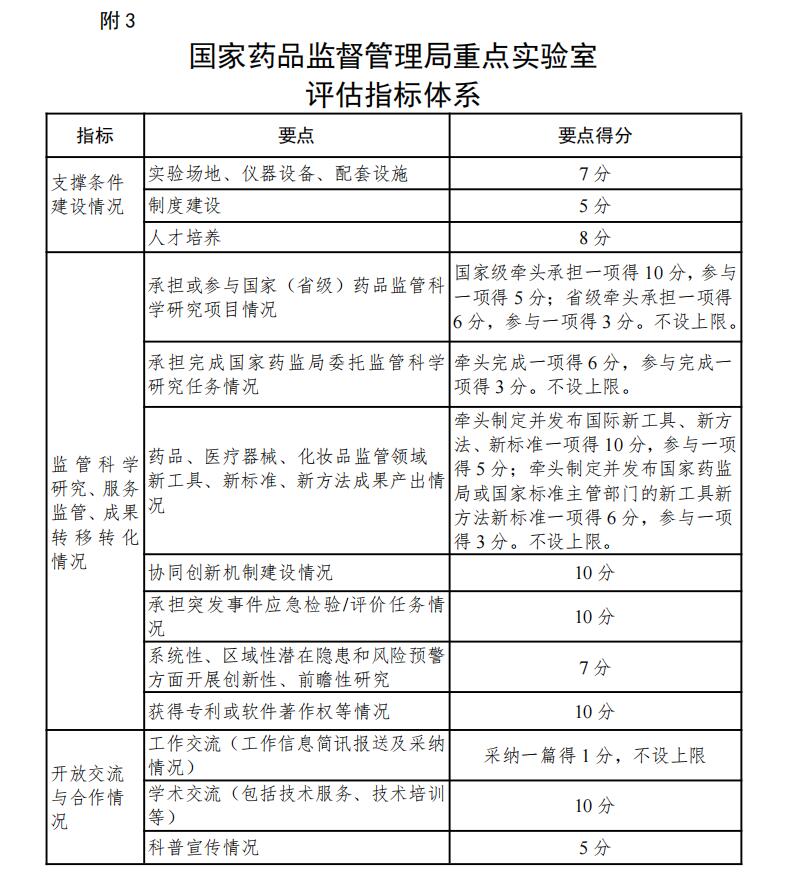
附:3.国家药品监督管理局重点实验室评估指标体系
附:4.国家药品监督管理局重点实验室评估指标体系说明
附:5.国家药品监督管理局重点实验室评估申请书
附:6.国家药品监督管理局重点实验室现场评估报告
附:7.国家药品监督管理局重点实验室评估专家打分表




附4
国家药品监督管理局重点实验室
评估指标体系说明
一、具体指标说明
(一)支撑条件建设情况
1.实验场地、仪器设备、配套设施
重点实验室依托单位实验场地、仪器设备、配套设施达到《药品检验检测机构能力建设指导原则》《医疗器械检验检测机构能力建设指导原则》《化妆品检验检测机构能力建设指导原则》(以下简称《原则》)B级及以上相关要求或者具备相应的能力建设要求,并满足进一步发展的条件。重点实验室按照建设方案落实科研条件计划情况。
2.制度建设
重点实验室日常管理制度健全,根据重点实验室建设方案建立相关科研、经费、人员、仪器设备、研究成果及转化应用、开放交流与合作研究等管理制度。
3.人才培养
重点实验室制定人才培养和引进政策措施,研究队伍知识、年龄层次结构合理,并达到《原则》B级及以上相关要求或者具备相应的能力建设要求;凝聚、吸引和稳定高水平人才的措施得力、业绩突出;团结合作,学术气氛浓厚。重点实验室落实建设方案中人才培养目标情况。
(二)监管科学研究、服务监管、成果转移转化情况
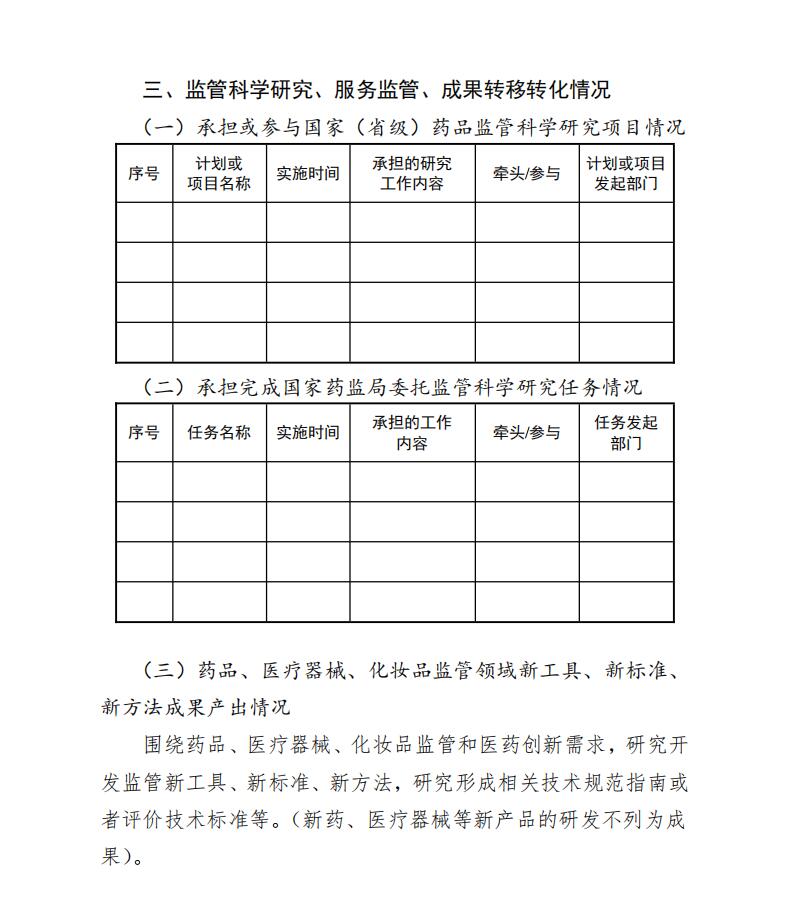
1.承担或参与国家(省级)药品监管科学研究项目情况
承担或参与科技部或省部级药品监管科学科研项目情况。
2.承担完成国家药监局委托监管科学研究任务情况
服务监管,承担国家局相关业务司局委托的监管科学研究任务情况。
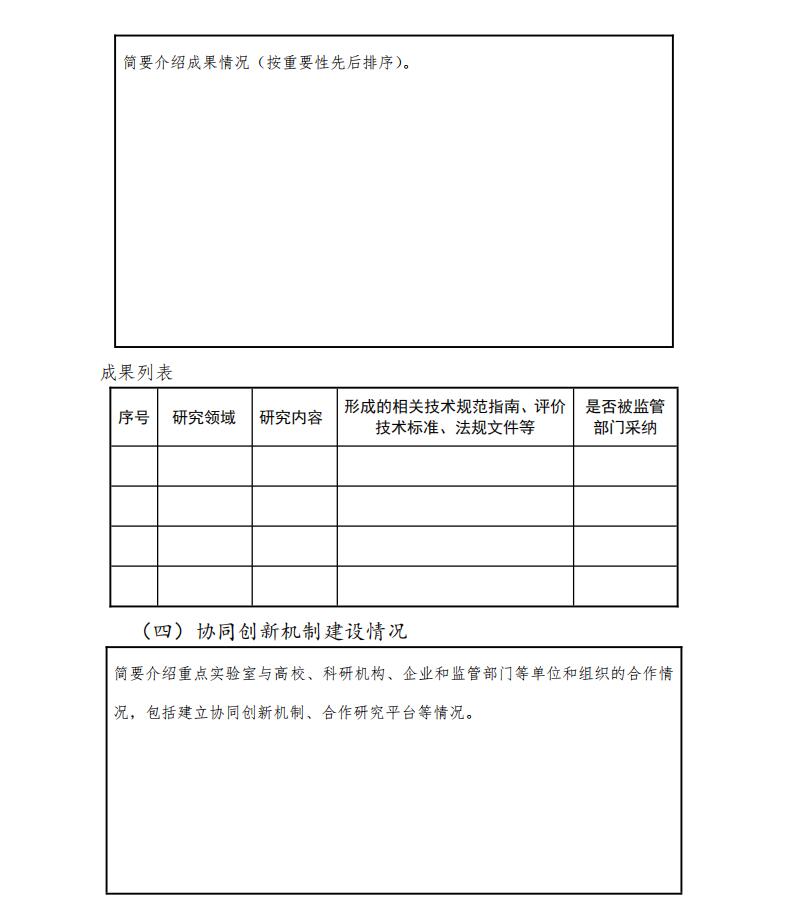
3.药品、医疗器械、化妆品监管领域新工具、新标准、新方法成果产出情况
围绕药品、医疗器械、化妆品监管和医药创新需求,研究开发监管新工具、新标准、新方法,研究形成相关技术规范指南或者评价技术标准等。
4.协同创新机制建设情况
重点实验室与高校、科研机构、企业和监管部门等单位和组织的合作情况,包括建立协同创新机制、合作研究平台等情况。
本要点重在考核重点实验室与监管需求方建立固定联系并维持沟通的机制情况。
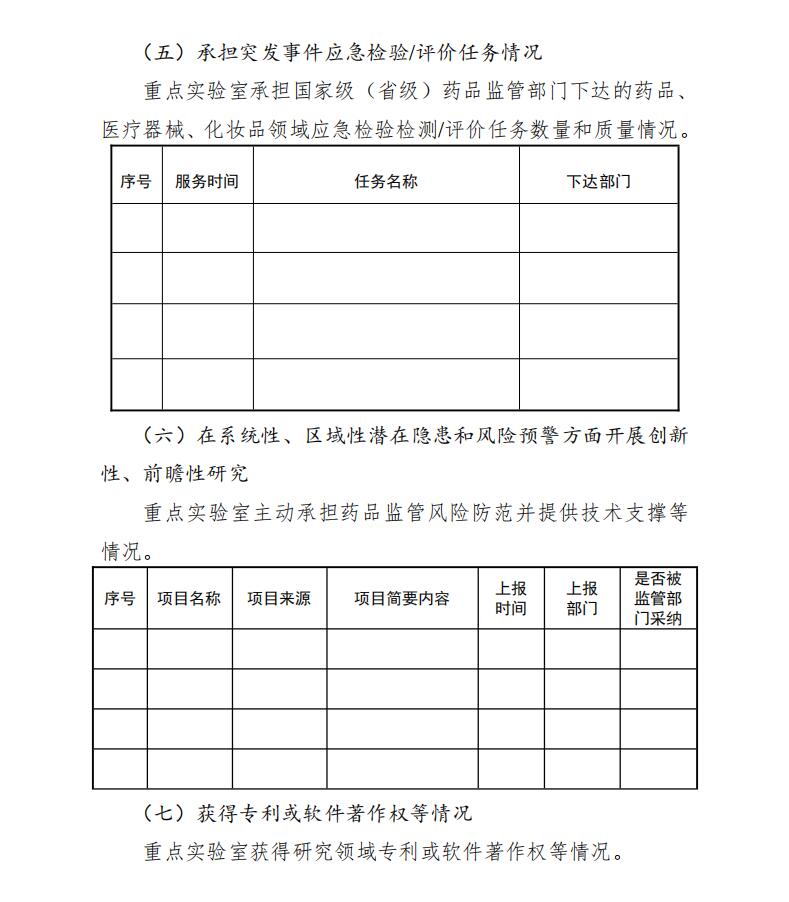
5.承担突发事件应急检验/评价任务情况
承担国家级(省级)药品监管部门下达的药品、医疗器械、化妆品领域应急检验检测/监测评价任务,保质保量完成的情况。
6.在系统性、区域性潜在隐患和风险预警方面开展创新性、前瞻性研究
主动承担药品监管风险防范并提供技术支撑等情况。本要点重点考核经过调研或数据分析等手段,发现药品相关风险,及时研究编制并报送风险报告,建立研究领域潜在风险识别技术,发现及预警系统性、区域性潜在风险隐患并被监管部门采纳。
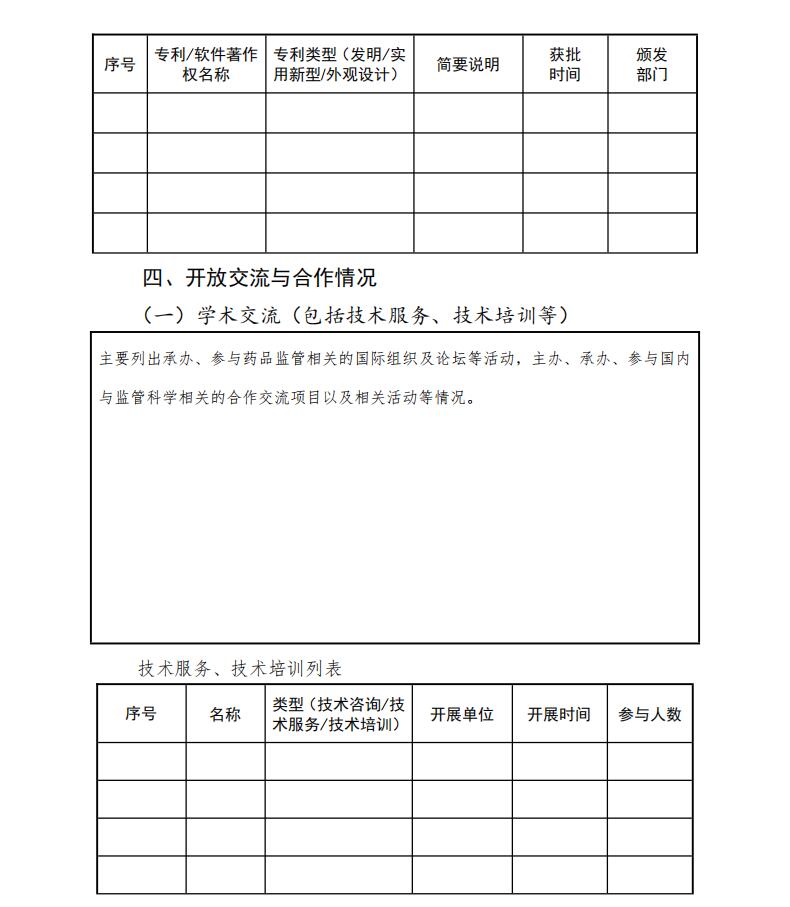
7.获得专利或软件着作权等情况
在开展药品监管科学研究中,与新工具、新方法、新标准相关的研究成果获得专利或软件着作权等。
(三)开放交流与合作情况
1.工作交流(工作信息简讯报送及采纳情况)
报送《国家药监局重点实验室工作简讯》等工作信息,展示和交流工作进展和工作亮点。
2.学术交流(包括技术服务、技术培训等)
承办、参与药品监管相关的国际组织及论坛等活动,提出中国方案,发出中国声音等。主办、承办、参与国内与监管科学相关的合作交流项目以及相关活动,积极展现研究成果和研究水平。
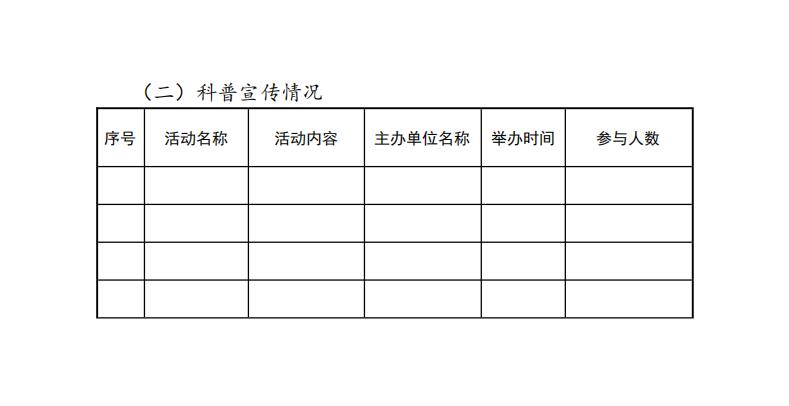
3.科普宣传
参与国家药监局主办的药品科技活动周等科普宣传情况。
二、评估结果
90分及以上优秀,75-89分良好,60-74分合格,60分以下不合格。

简表填写说明
1.各类经费均按规定的评估期限内的总额计算。
2.队伍建设栏中“国际、国家或省部级相关组织任职”是指重点实验室固定人员在国际、国家级、省部级相关组织任职的人数。
3.开放交流栏中国际合作科研计划指:重点实验室参与国际科学研究计划的项目数。