各省、自治区、直辖市药品监督管理局,中检院:
为贯彻落实《医疗器械监督管理条例》有关规定,进一步加强医疗器械质量抽查检验复检工作,现决定开展医疗器械质量抽查检验复检机构推荐工作。现将有关事项通知如下:
一、推荐原则
推荐的检验机构应当具备医疗器械检验资质和复检工作能力,具有丰富的医疗器械检验和相关研究经验,有意愿承担医疗器械复检工作,能够及时、准确、规范完成复检工作。
二、推荐条件
(一)基本条件
1.依法成立的医疗器械检验机构,具有独立法人资格,能够承担相应法律责任。不具备独立法人资格的,需经所在法人单位授权。
2.取得医疗器械领域的检验检测机构资质认定(CMA),且取得资质认定的能力范围能够满足复检工作需要。
3.拥有完备的医疗器械检验检测机构质量管理体系,并能够持续良好运行。
4.能够对出具的检验报告负责,并承担相应的法律责任。
5.自2016年起,承担2年(含)以上由国家药品监督管理部门委托的国家医疗器械抽检任务(包括监督抽检、风险监测涉及的检验任务)。
6.近3年无违法违规行为,未发生重大质量安全事故。
(二)能力要求
1.近3年组织或参加3次(含)以上医疗器械领域的国际能力验证、国家级检验检测机构能力验证,并取得满意结果。
2.具备与复检项目相匹配的检验工作经历,配备与复检项目相匹配的固定且能够独立运行的实验场所、实验室环境设施、人员及技术能力。
3.具备在医疗器械相关法规、标准、规范等变化时,及时进行相应变更和扩项的能力。
4.具备对检验结果进行分析研判,并按照要求开展相关技术交流的能力。
5.检验报告授权签字人具有3年(含)以上医疗器械检验检测领域工作经验,并具有高级专业技术职称。
三、工作程序
(一)推荐。每个省级药品监督管理部门原则上推荐1家辖区内的医疗器械检验机构。中检院推荐全国范围内3家医疗器械检验机构。无符合条件的,可不推荐。
(二)专家评审。各省级药品监督管理部门、中检院书面推荐后,通过国家医疗器械抽检信息系统提交申报材料,中检院组织专家对提交的材料进行评审。
(三)现场核查。中检院组织对通过专家评审的检验机构开展现场核查,重点核查申报材料的真实性,并对检验机构整体质量体系和实际工作情况进行审查。
(四)发布名单。根据专家评审、现场核查的情况,兼顾复检工作需要及复检机构地域分布,形成复检机构名单,经国家药监局核准后发布。
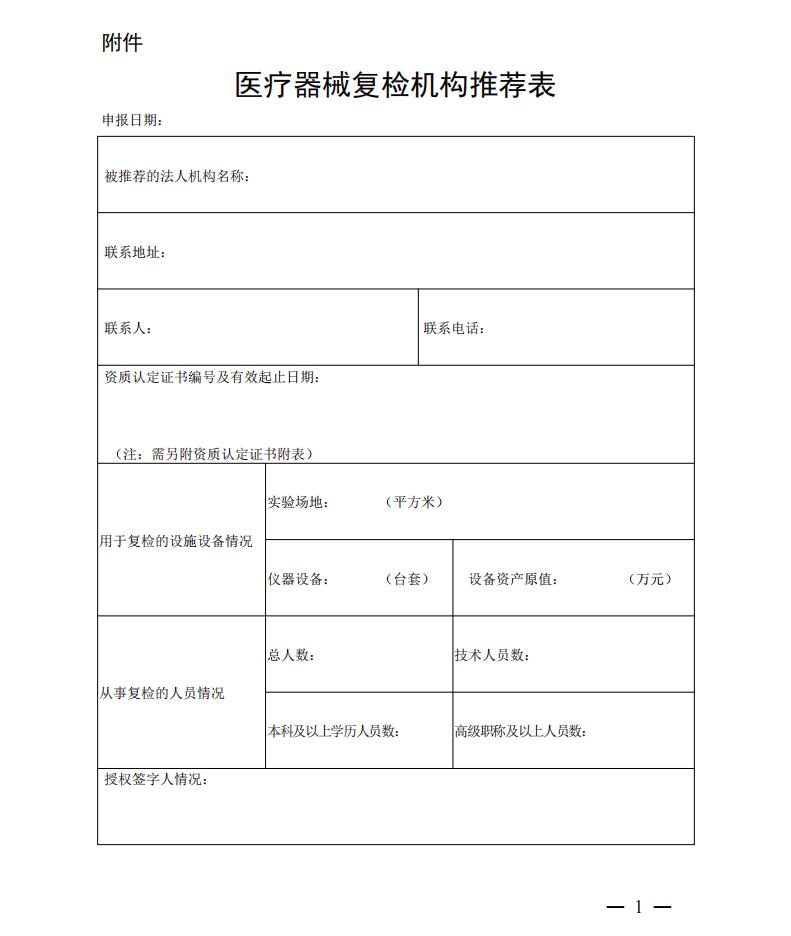
各省级药品监督管理部门和中检院应当高度重视,充分认识医疗器械复检工作的重要性,严格按照原则、条件和程序组织开展推荐工作。请于2021年4月30日前研究确定推荐机构,按要求填写《医疗器械复检机构推荐表》(见附件),并附佐证材料(原件一套由省级局留存至少五年),同时在国家医疗器械抽检信息系统中上传推荐表及佐证材料的电子扫描件。
联系人:中检院技术监督中心 郝擎(010-53851433)
器械监管司 王晓雪(010-88330619)
附件:医疗器械复检机构推荐表

国家药监局综合司
2021年3月15日