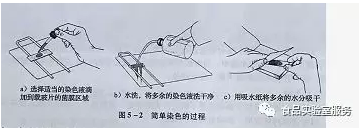
不同的细菌,或者由于观察者所侧重观察的内容不同一,所以所使用的染料也有差异,但是简单染色的方法是一样的。先按照上述的制片方法制片,制成需要观察的玻片后,使用相对应的染料滴加到玻片上菌膜区域,以覆盖菌膜为准。按照不同染料的要求,结合所观察的内容确定染色时间,染色时间到达时,进行水洗,干燥等步骤(见图5-2)。最后得到的玻片加盖盖玻片即可进行镜检。如有需要可以后续再进行油封、蜡封等封片过程。
二、芽孢染色法
芽孢杆菌属和梭状芽孢杆菌属的细菌能产生内孢子,这些孢子耐高温、干旱及有毒化学试剂。内孢子还能抵制细菌染色液的进入,在革兰氏染色法涂片染色时,革兰氏阳性菌的芽孢呈现无色。然而,芽孢一旦着色后就很难脱色。
虽然芽孢通常可在革兰氏染色片中看到(芽孢由于不易让染料进入多呈现无色),但在不易清晰观察时,可用特殊的芽孢染色法,使芽孢与菌体呈现不同颜色,更便于观察。其实验的操作方法与革兰氏染色类似。主要的芽孢染色法有以下两种。
(一)孔雀绿染色法
(1)将生有芽孢的斜而菌苔按革兰氏染色法涂片后,用饱和孔雀绿水溶液(约为
7.6%)染10 min。
(2)用自来水冲洗。
(3)用0.5%番红液复染30%.
(4)水洗,吸干。
(5)镜检:芽孢呈绿色,菌体和芽抱囊呈微红色,但应注意菌体中有异染粒时,也可呈绿色。
(二) 石炭酸复红染色法
(1)按常规涂片。
(2)滴加石炭酸复红于涂片上,并于玻片下缓缓加热,使染液冒蒸气但不沸腾,并继续滴加染液,不使涂片上染液蒸干,这样保持5 min。
(3)涂片冷却后,倾去染液,用酸性乙醇脱色至无红色染剂洗脱为止。
(4)彻底水洗。
(5)用吕氏美蓝复染2 min -3 min。
(6)水洗、吸干。
(7)镜检:镜检时,菌体及孢囊呈蓝色,芽孢呈红色。
具体实验时,在对一些特殊芽孢染色时,需要对染色液和复染液进行修改。
三、鞭毛染色
鞭毛是细菌的运动器官,非常纤细,直径一般为10nm~20 nm,超出了光学显微镜的观察极限,因此通常情况下在显微镜下观察不到鞭毛。通过使用特殊的染色技术,可以将染色液附加到鞭毛的周围,增加它的直径,从而能够在光学显微镜下观察到鞭毛,而且能检测鞭毛在细菌中的分布。尤其是鞭毛染色可用于区分假单胞菌科的一些有两极鞭毛的细菌和肠杆菌科有周身鞭毛的细菌(在运动时)。
鞭毛十分细小,很容易从细菌上脱离,所以要得到非常满意的鞭毛染色玻片十分困难。另外,很多染色方法会产生沉淀物,这又使得观察鞭毛十分困难。
鞭毛染色一般分为两类:一种是银盐法,使银在鞭毛上堆积;另一种是使用复红沉积在鞭毛上。
(一)银盐沉积法(改进的Fontana方法)
应使用绝对干净(无油脂)的载玻片进行染色,最好是新的无油载玻片。用过的载玻片要在酪酸洗液中浸泡,并用蒸馏水冲洗干净后方可再次使用。
细菌在琼脂斜面上,比最佳生长温度低3℃~5℃的温度下培养,可在斜面上加1滴~2滴灭菌的生理盐水保持湿度。
(1)将载玻片在火焰上快速灼烧5s,放在染色架上冷却,用蜡笔分成两个区域(用镊子夹住载玻片的一端)。
(2)用移液管或巴斯德移液管移取2mL无菌水加入到幼龄(通常为18 h)、生长活跃的斜面菌株中,慢慢振荡并旋转试管使菌株悬浮。建议尽量避免使用接种环。然后转移到干净的试管中,通过悬滴试验检查菌体的运动性。用无菌水将悬浮液稀释至略有浑浊为止。放入20 ℃ -30 ℃培养箱中培养30 min,然后移取一满环悬浮液加在已冷却的载玻片一端。倾斜载玻片让液滴流到蜡笔画的中心线。在空气中自然干燥,不要加热玻片。
(3)用媒染色剂媒染5 min。
(4)慢慢用蒸馏水充分漂洗掉所有的媒染液。
(5)用热的Fontana银液覆盖,染色5 min,每隔1 min更换1次染色液( Fontana银液在沸水浴中加热)。细菌涂层的每一部分都始终要浸在染色液中,不能裸露。
(6)用水冲洗,在空气中晾干,镜检。
(二) Leifson替代染色法
下述Leifson鞭毛染色法可以代替上述方法的(3) ~(6)。
(1)滴加1 ml的Leifson鞭毛染色液,注意不要使染色液干燥,直到玻片上形成细微的铁锈色沉淀(约10 min) 。
(2)慢慢地用蒸馏水充分冲洗干净。
(3)用1%的亚甲基蓝复染5 min ~10 min。
(4)用水洗净,空气中干燥,镜检。没有复染时,细胞和鞭毛都呈现桃红色,复染后,细胞染成蓝色,鞭毛染成红色。
实验中需要注意的是鞭毛很容易脱落,若观察时视野中大多为周身鞭毛细胞,说明该菌是周毛菌,但若观察到一个明显的极端鞭毛细胞时,并不一定说明不是周毛菌。
注意事项:
(1)适宜的培养基、温度和通气条件下,以短期内多次连续接种培养的幼龄菌种鞭毛情况最好。因此,用于鞭毛染色的菌种常常用幼龄菌,菌龄老化或某些培养条件变化常导致鞭毛脱落或丧失。
(2)玻片应清洁无油污。鞭毛非常纤细且容易脱落,故操作过程动作要轻。
(3)染色法的染料须当日配制, 4 h内效果最好。所以鞭毛染色液最好现用现配。
四、荚膜染色
荚膜是某些细菌在新陈代谢过程中形成的,分泌于细胞壁外的一层胶状黏液性物质,主要化学成分是多糖类物质。荚膜的折光性低,易溶于水,与染料亲和力低,但荚膜的通透性比较好,某些染料可透过荚膜而使菌体着色。因此染色后在菌体周围有一浅色或无色的透明圈,即为荚膜。一般采用负染色的方法,使背景与菌体之间形成一透明区,将菌体衬托出来便于观察分辨,故又称衬托法染色。因荚膜薄,且易变形,所以不能用加热法固定。
具体操作步骤(见图5-8)。
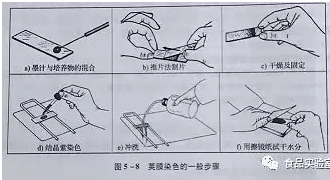
(一)制片
加1滴6%葡萄糖水溶液于载玻片一端,无菌操作,挑取细菌斜面上培养72 h左右的胶质芽孢杆菌与其混合。
(二)推片法制片
加1滴墨汁充分混匀。用推片法制片,将菌液铺成薄层, 自然干燥。
(三)固定
滴加1滴~2滴无水乙醇覆盖涂片,固定1 min, 自然干燥;也可以不加处理, 自然干燥。
注意:不能用火加热干燥。
(四)结晶紫染色
在已自然晾干的涂面上,滴加1%结晶紫染色液染色。
(五)冲洗
2 min后,以20%硫酸铜冲洗数次。再用自来水冲洗1次。
(六)拭干水分后镜检
用擦镜纸拭干水分后镜检。有荚膜的菌菌体呈紫色,背景灰黑色,荚膜不着色呈无色透明圈。无荚膜的菌,由于干燥菌体收缩,菌体四周也可能出现一圈狭窄的不着色环,但这不是荚膜,荚膜不着色的部分宽。
五、死活染色
在显微镜下活细胞细胞膜完整、立体感强,细胞质透明度好,颗粒状物质少;死细胞膜破裂,无立体感,细胞通透性差,有颗粒状物质、空泡。
染色排除法是生物研究中判断细胞活性的一种常用方法,简便,易于操作,实验是利用了死活细胞在生理机能和性质上的差异来进行的。原理:因为活细胞的细胞膜具有选择透过性,细胞不需要的物质通常不进入细胞,染色剂中如台盼蓝能进入死细胞,从而可以使死细胞染色。依此染色便可以判断细胞的活性。
活细胞必须要通过控制物质进出细胞膜来保持内部生理环境的稳定性。细胞死后,细胞膜通透性发生改变,原先不能进入细胞的物质也能够进入细胞。常见的细胞染料有:中性红、台盼蓝、甲基蓝、美蓝、荧光素双乙酸酯等。台盼蓝染料正常情况下被活细胞拦在细胞膜外,只有细胞膜受损或者细胞死亡后,才能进入细胞,从而与解体的DNA结合,使其着色,因此,活细胞一般不被台盼蓝染色,而死细胞会被染成蓝色。通过显微镜观察很容易识别出死亡的染色细胞,并可用细胞计数板进行计数。
用美蓝染色液可以对酵母菌细胞进行死活染色鉴别。美蓝是一种弱氧化剂,氧化态呈蓝色,还原态呈无色。活的酵母因为新陈代谢不断进行,具有一定的还原能力,能将进入细胞的美蓝还原,而细胞不染色。因此,用美蓝对酵母细胞染色一定时间后,无色的为活细胞,蓝色的为死细胞。需要注意的是:一个活细胞的还原能力是有限的,必须严格控制染色的时间和染料的浓度。
方法:取0.1%美蓝液一滴,滴在玻片中央,加一滴酵母菌悬液,混匀。染色3 min ~5 min后,加盖片制成水浸标本片,即可镜检,这种方法也适用于细菌和霉菌。