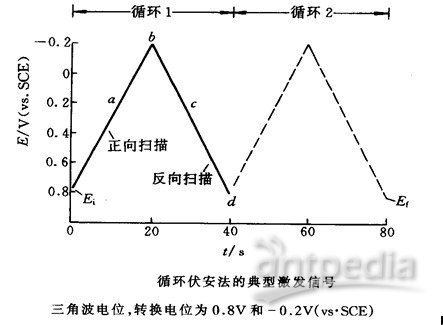
伏安分析法是在一定电位下测量体系的电流,得到伏安特性曲线。根据伏安特性曲线进行定性定量分析。如以等腰三角形的脉冲电压(三角波)加在工作电极上,得到的电流电压曲线包括两个分支,如果前半部分电位向阴极方向扫描,电活性物质在电极上还原,产生还原波,那么后半部分电位向阳极方向扫描时,还原产物又会重新在电极上氧化,产生氧化波。因此一次三角波扫描,完成一个还原和氧化过程的循环,故该法称为循环伏安法,其电流~电压曲线称为循环伏安图。如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差。循环伏安法中电压扫描速度可从每秒种数毫伏到1伏。工作电极可用悬汞电极,或铂、玻碳、石墨等固体电极。

检验方法原理
[Fe(CN)6]3-~[Fe(CN)6]4-是典型可逆的氧化还原体系,其氧化还原电对的标准电极电位为:
[Fe(CN)6]3- + e- = [Fe(CN)6]4- φ θ = 0.36V ( vs.NHE )
电极电位与电极表面活度的Nernst方程式为:
φ = φ θ + RT/Fln(COx/CRed)
在一定扫描速率下,从起始电位(-0.2V)正向扫描到转折电位(+0.8V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(+0.8V)变到原起始电位(-0.2V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。在0.1MNaCl溶液中K4[Fe(CN)6]的扩散系数为0.63×10-5cm·s-1;电子转移速率大,为可逆体系(1MNaCl溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s-1)。溶液中的溶解氧具有电活性,用通入惰性气体除去。
Epc、Epa分别为阴极峰值电位与阳极峰值电位。Ipc、Ipa分别为阴极峰值电流与阳极峰值电流。这里P代表峰值,a代表阳极,c代表阴极。
正扫时(向左的扫描)为阴极扫描:
Fe(CN)63- + e- = Fe(CN)62-
反扫时(向右的扫描)为阳极扫描:
Fe(CN)62- - e- = Fe(CN)63-
对可逆体系:
① ipa / ipc=1
② 还原峰电位和氧化峰电位电位差:△Φ= Φpa - Φpc= 0.056/n V
式量电位: = (Φpa + Φpc)/ 2
对可逆体系的正向峰电流,由Randles-Savcik方程可表示为:
其中,ip为峰电流(A);n为电子转移数;A为电极面积(cm2);D为扩散系数(cm2·s-1);v为扫描速度(V s-1);c为浓度(mol·L-1)。
实验步骤
1.配置溶液,铁氰化钾标准溶液(5.0×10-2mol·L-1),氯化钾溶液(1.0 mol·L-1)。
2.工作电极的预处理:玻碳电极用含Al2O3粉末(粒径0.05 ?m)的抛光布抛光,然后用蒸馏水超声清洗。
3.将电极系统置于待测试液中,打开仪器,设置参数,进行实验。
4.支持电解质的循环伏安图:在电解池中放入1.0 mol·L-1 KCl溶液,插入电极,以新处理的铂电极为指示电极(绿色夹子),铂丝电极为辅助电极(红色夹子),饱和甘汞电极为参比电极(白色夹子),进行循环伏安仪设定,扫描速率为20mV/s;起始电位为-0.2 V;终止电位为+0.8 V,灵敏度1.e-0.04。静置一分钟后,开始循环伏安扫描,记录循环伏安图。
5.K4[Fe(CN)6]溶液的循环伏安图:分别作0.02、0.04、0.08、0.12、0.16mol·L-1的K4 [Fe(CN)6]溶液(均含支持电解质NaCl浓度为0.10 mol·L-1)循环伏安图。
6.不同扫描速率K4 [Fe(CN)6]溶液的循环伏安图:在0.16 mol·L-1 K4 [Fe(CN)6]溶液中,以20、40、60、80、100mV·s-1,在-0.2至+0.8 V电位范围内扫描,分别记录循环伏安图。
注意事项
1.实验前电极表面要处理干净,这是影响实验的主要因素;
2.扫描过程保持溶液静止。
其他
1.绘制出同一扫描速度下的铁氰化钾浓度(c)同ipa与ipc的关系曲线。
2.绘制出同一铁氰化钾浓度下的ipa和ipc与相应的v1/2的关系曲线图。